题目内容
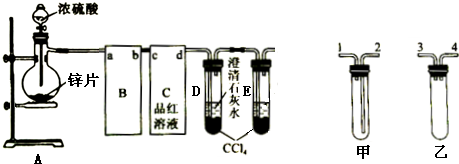
6.在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀.然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体.请回答:(1)生成的黑色(单质)物质是C(填化学式).
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是SO2(填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑.
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有CD(填序号).
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4)将实验②产生的刺激性气味气体通入品红溶液,可以看到品红溶液褪色说明这种气体具有漂白性;将②中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式SO2+H2O=H2SO3.
(5)能否用澄清石灰水鉴别这两种气体?不能(填“能”或“不能”)若不能请填写两种能鉴别的试剂品红试液、溴水(或酸性高锰酸钾溶液).
分析 (1)将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质为碳;
(2)脱水过程中反应放热,所生产的碳和浓硫酸反应生成二氧化硫、二氧化碳和水;
(3)反应过程中表现了浓硫酸的脱水性生成碳,还与碳反应生成二氧化硫、二氧化碳和水,表现了强氧化性;
(4)产生的有刺激性气味的气体为二氧化硫,通入品红溶液中褪色,是二氧化硫的漂白性;二氧化硫与水反应生成亚硫酸;
(5)二氧化碳、二氧化硫通入澄清石灰水都能变浑浊,不能用来鉴别;可以利用品红溶液、溴水、酸性高锰酸钾等试剂鉴别两种气体.
解答 解:(1)将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,把蔗糖中的氢元素和氧元素按照2:1脱去,生成黑色物质是C,体现了浓硫酸的脱水性,
故答案为:C;
(2)黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是二氧化硫,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑,
故答案为:SO2;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑;
(3)将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质碳表现了浓硫酸的脱水性,黑色物质继续与浓硫酸作用会产生两种气体,体现了浓硫酸的强氧化性,该过程中没有表现出酸性和吸水性,
故答案为:CD;
(4)有刺激性气味的气体通入品红溶液中,可以看到品红溶液褪色,表现了二氧化硫的漂白性,二氧化硫和水反应生成亚硫酸,反应的化学方程式为SO2+H2O=H2SO3,
故答案为:褪色;漂白;SO2+H2O=H2SO3;
(5)根据反应CO2+Ca(OH)2=CaCO3↓+H2O、SO2+Ca(OH)2=CaSO3↓+H2O可知,二氧化硫和二氧化碳通入澄清石灰水都会生成沉淀溶液变浑浊,不能用澄清石灰水鉴别两种气体;可以利用品红试液、溴水或酸性高锰酸钾溶液等鉴别,
故答案为:不能;品红试液、溴水(或酸性高锰酸钾溶液).
点评 本题考查了浓硫酸性质及其应用,题目难度中等,明确发生反应的原理为解答关键,注意熟练掌握浓硫酸的吸水性、脱水性和强氧化性的含义及区别,试题侧重考查学生灵活应用基础知识的能力.

| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
| A. | 铁 | B. | 氧 | C. | 钾 | D. | 钙 |
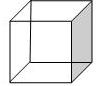 “立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示
“立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示 .
.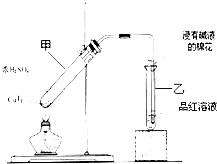 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题: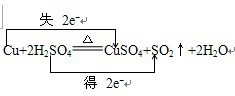 .
.