题目内容
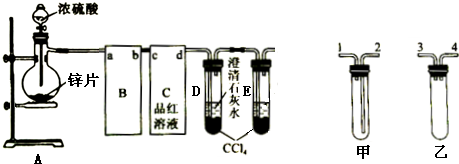
2.冷的浓硫酸、浓硝酸在工业上常用铁质容器盛装.为研究铁质材料与热浓硫酸的反应,某校化学学习小组进行了以下探究活动:(1)称铁钉9.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用d.
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性 KMnO4溶液
②乙同学将气体Y通入足量的硝酸钡溶液中,观察到有白色沉淀生成,请写出反应的离子方程式:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
(2)丙同学认为气体Y中还可能含有H2和Q气体.为此设计了如图探究实验装置(图中夹持仪器省略)

①认为气体Y中还含有Q的理由是C+2H2SO4(浓硫酸)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O(用化学方程式表示).
②为确认Q的存在,需在装置中添加M于c.
a. A之前 b.A-B间 c.B-C间 d.C-D间
③若要测定限定体积气体Y中H2 的含量(标准状况下约有28mLH2),除可用测量H2 体积的方法外,可否选用称量质量的(用中学化学实验室最常用的称量器具)方法否,理由是用托盘天平无法称量D或E的差量.
分析 (1)①根据亚铁离子的性质选取试剂,亚铁离子有还原性,可用强氧化性的物质检验,且必须有明显的实验现象;
②二氧化硫能够与硝酸钡溶液反应生成硝酸、硫酸钡和一氧化氮气体,据此写出反应的离子方程式;
(2)①根据铁钉的成分分析,铁钉中的铁和碳在加热条件下都能与浓硫酸发生氧化还原反应;
②根据二氧化硫和二氧化碳的性质分析选择位置;
③计算出氢气的物质的量及生成水的质量,然后根据中学阶段质量的称量选择托盘天平,分度值是0.1g进行判断.
解答 解:(1)①亚铁离子能使酸性高锰酸钾褪色,溶液中已经有三价铁离子,选择a会造成干扰,b能检验三价铁离子的存在,选c生成两种沉淀,受氢氧化铁沉淀颜色的影响无法分辨,只有d能够具有亚铁离子,
故答案为:d;
②SO2为酸性氧化物,溶于水溶液显示酸性,通入硝酸钡后发生氧化还原反应生成硫酸钡、NO气体和硝酸,反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+;
(2)①在加热时,铁钉中不仅铁和浓硫酸反应,碳也和浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓硫酸)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓硫酸)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,所以应该放在B-C之间,即c正确,
故答案为:c;
③标况下28mL氢气的物质的量为:$\frac{0.028L}{22.4L/mol}$=0.00125mol,生成水的质量为:18g/mol×0.00125mol=0.0225g,即D、E的质量差小于0.1g,
而中学阶段质量的称量选择托盘天平,分度值是0.1g,无法精确称量出D或E的差量,所以不能用通过托盘天平称量质量差的方法测量氢气含量,
故答案为:否;用托盘天平无法称量D或E的差量.
点评 本题考查了浓硫酸的性质、实验方案的设计与评价,题目难度中等,注意掌握性质实验方案设计的原则及评价方法,明确常见气体的性质及检验方法,(2)③为易错点,需要通过计算进行判断.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应片刻后速率:X>Y |
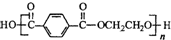 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )| A. | 羊毛的主要成分属于蛋白质 | |
| B. | 涤纶属于天然高分子化合物 | |
| C. | 合成涤纶的单体之一可以是HOCH2CH2OH | |
| D. | 可用灼烧的方法区别羊毛和涤纶 |
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 10种 |
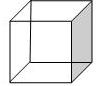 “立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示
“立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示 .
.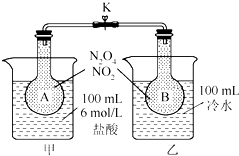 如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL 6mol/L的HCl的溶液中放入25gNaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.
如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL 6mol/L的HCl的溶液中放入25gNaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.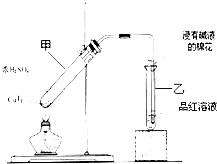 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题: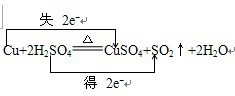 .
.