题目内容
3.按要求填写:(1)羟基的电子式:
 ;
;(2)苯酚钠溶液中通入少量CO2的反应方程式:C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3;
(3)蔗糖水解反应方程式:C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
分析 (1)羟基是电中性基团,氧原子与氢原子以1对共用电子对连接;
(2)苯酚钠溶液和二氧化碳反应生成苯酚和碳酸氢钠;
(3)在催化剂条件下,蔗糖水解生成葡萄糖和果糖且二者物质的量相等.
解答 解:(1)羟基是电中性基团,氧原子与氢原子以1对共用电子对连接,电子式为 ,故答案为:
,故答案为: ;
;
(2)苯酚钠溶液和二氧化碳反应生成苯酚和碳酸氢钠,反应方程式为C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3,故答案为:C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3;
(3)蔗糖属于双糖,可以水解生成单糖.即:C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖),故答案为:C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
点评 本题考查化学方程式及电子式的书写,明确物质性质及电子式书写方法即可解答,注意羟基和氢氧根离子电子式区别,注意:无论二氧化碳多少,二氧化碳和苯酚钠溶液反应都生成碳酸氢钠,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g)  2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器 | 甲 | 乙 | 丙 | 丁 |
起始投料量 | 2molSO2 1mol O2 | 1 mol SO2 0.5mol O2 | 2mol SO3 | 2mol SO2 2mol O2 |
反应放出或吸收的热量(kJ) | a | b | c | d |
平衡时c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
11.下列关于有机物的叙述不正确的是( )
| A. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 分子式为C3H7Cl的同分异构体共有2种 | |
| D. | 谷氨酸分子(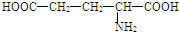 )间缩合可形成二肽 )间缩合可形成二肽 |
18.某有机物结构简式如图,该有机物不可能具有的性质是( )
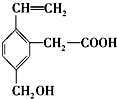

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 能发生酯化反应 | |
| C. | 能在铜作催化剂的条件下发生催化氧化 | |
| D. | 能与4mol溴单质发生加成反应 |
8. 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子最外层有4种不同运动状态的电子,F位于ds区.
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
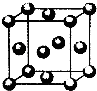
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
9.下列结论均出自《实验化学》中的实验,其中错误的是( )
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
10.某原电池总反应的离子方程式为2Fe3++Fe═3 Fe2+,能实现该反应的原电池组成是( )
| A. | 正极为铁,负极为铜,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
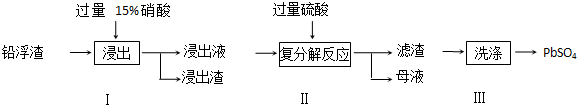
 .(其它无机物任选)
.(其它无机物任选)