题目内容
11.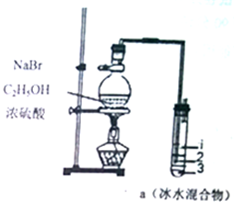 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )| A. | 产物在a中第一层 | |
| B. | a中有产物和水,还含HBr、Br2、CH3CH2OH等 | |
| C. | 反应过程中浓硫酸显示酸性、强氧化性、脱水性、难挥发性等性质 | |
| D. | 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等 |
分析 NaBr、乙醇在浓硫酸作用下加热,发生取代反应生成溴乙烷,同时发生反应生成HBr,因浓硫酸具有强氧化性,可生成Br2,实验结束发现试管a中的物质分为三层,因溴乙烷的密度比水大,则一定在下层,以此解答该题.
解答 解:A.溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,故A错误;
B.在加热条件下反应,HBr和CH3CH2OH都易挥发,因浓硫酸具有强氧化性,可生成Br2,故生成物中有存在HBr、Br2、CH3CH2OH,故B正确;
C.反应生成HBr,浓硫酸表现酸性,生成Br2,浓硫酸表现强氧化性,可能生成乙烯,浓硫酸表现脱水性,硫酸沸点高,难挥发,故C正确;
D.乙醇和溴化氢在加热下发生取代反应生成溴乙烷;溴化氢与浓硫酸发生氧化还原反应生成单质溴、二氧化硫和水,可能生成乙烯,浓硫酸表现脱水性,故D正确.
故选A.
点评 本题考查溴乙烷的制取,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的原理,为解答该题的关键,难度不大.

练习册系列答案
相关题目
2.下列各物质中均能导电且导电本质不同的是( )
| A. | 石墨和稀硫酸 | B. | 金属铝和金属铜 | ||
| C. | 金刚石和晶体硅 | D. | 液态HCl和液态NaCl |
19.食品卫生与身体健康密切相关,下列物质可以用作食品添加剂的是( )
| A. | 苯甲酸钠 | B. | 瘦肉精 | C. | 三聚氰胺 | D. | 甲醇 |
6.兴奋剂是体育比赛中禁用的药物,有一种兴奋剂的结构如图,关于它的说法中正确的是( )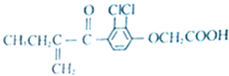

| A. | 分子中有4个碳碳双键 | |
| B. | 该有机物能发生银镜反应 | |
| C. | 既能发生还原反应,又能发生氧化反应 | |
| D. | 1mol该物质最大跟6mol氢气发生反应 |
16.2015年4月14日“阳光动力2号”飞机抵达南京.它使用了约1.7万块高性能硅电池板,则它的动力来源是( )
| A. | 核能 | B. | 化石能源 | C. | 太阳能 | D. | 风能 |
20.关于如图所示铜锌原电池的说法正确的是( )
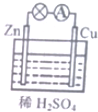

| A. | 原电池的反应本质是氧化还原反应 | B. | 电子由Cu片通过导线流向锌片 | ||
| C. | 正极反应式为Zn-2e=Zn2+ | D. | Cu为负极,Zn为正极 |
1.下列化学性质叙述或有关化学反应表达正确的是( )
| A. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 除去乙烷中混有的乙烯的方法是通氢气在一定条件下反应,使乙烯转化为乙烷 |
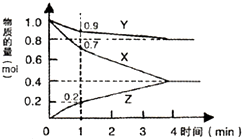 (1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.
(1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.