题目内容
15.某同学用如图所示装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2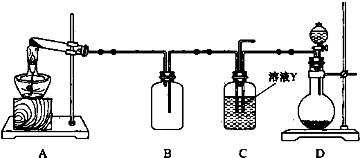
(1)下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2d.NaOH e.浓氨水
f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为ac(用药品序号填空,下同);装置D处固体药品的最佳选择为b(用药品序号填空).
(2)下列各项制备实验中,也可利用装置D处仪器完成的是E(填序号).
A.MnO2与浓盐酸反应制备Cl2B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
(3)写出上述装置A处的试管中所发生反应的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(4)简述用pH试纸测定装置C处溶液pH的方法是用洁净、干燥的玻璃棒蘸取待测液点在pH试纸中部,待变色后立即与标准比色卡对比读数.
分析 (1)从装置图可知,A用来制取氨气,D用来制取二氧化碳,根据此装置目的选择试剂;
(2)装置D制备气体的特点为固体+液体不加热;
(3)氯化铵与氢氧化钙加热生成氯化钙、氨气和水;
(4)根据pH试纸使用步骤回答.
解答 解:(1)))①从装置图可知,A用来制取氨气,所用试剂为氯化铵和氢氧化钙,D用来制取二氧化碳,所用固体试剂为大理石,
故答案为:ac;b;
(2)A.MnO2与浓盐酸反应制备Cl2,需要加热,故A不选;
B.Cu与浓硫酸反应生成SO2,需要加热,故不选;
C.由KMnO4分解制O2,需要加热,故不选;
D.乙醇与乙酸反应制备乙酸乙酯,需要加热,故不选;
E.Zn与稀硫酸反应制备H2,需要加热,可以用D制备,故E选;
故答案为:E;
(3)氯化铵与氢氧化钙加热生成氯化钙、氨气和水,反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(4)用pH试纸测定溶液pH值的方法是:用洁净、干燥的玻璃棒蘸取待测液点在pH试纸中部,待变色后立即与标准比色卡对比读数;
故答案为:用洁净、干燥的玻璃棒蘸取待测液点在pH试纸中部,待变色后立即与标准比色卡对比读数.
点评 本题考查了氨气、二氧化碳气体的制备,明确反应原理及发生装置选择的依据是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
20.下表是不同温度下水的离子积常数:
?试回答以下问题:
(1)若25<T1<T2,则a>1×10-14 (填“>”、“<”或“=”),做此判断的理由是水的电离吸热,温度升高,水的电离程度增大,所以水的离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b mol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是a+b=14.
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
(1)若25<T1<T2,则a>1×10-14 (填“>”、“<”或“=”),做此判断的理由是水的电离吸热,温度升高,水的电离程度增大,所以水的离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b mol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是a+b=14.
7.下列实验方案能达到预定目的是( )
| A. | 将SO2通入石蕊试液中证明SO2有漂白性 | |
| B. | 用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱 | |
| C. | 向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42- | |
| D. | 用干燥的pH试纸可测得新制氯水的pH=2 |
4.工业上常用氨碱法制取碳酸钠(将氨和二氧化碳分别先后通入饱和食盐水而析出小苏打,再经过滤、焙烧,得纯碱),却不能用氨碱法制碳酸钾,这是因为在溶液中( )
| A. | KHCO3溶解度较大 | B. | KHCO3溶解度较小 | C. | K2CO3溶解度较大 | D. | K2CO3溶解度较小 |
5.过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.根据四个H2O2参与的化学方程式判断下列说法正确的是( )
①Na2O2+2HCl=2NaCl+H2O2
②Ag2O+H2O2=2Ag+O2↑+H2O
③2H2O2=2H2O+O2↑
④3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O.
①Na2O2+2HCl=2NaCl+H2O2
②Ag2O+H2O2=2Ag+O2↑+H2O
③2H2O2=2H2O+O2↑
④3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O.
| A. | 上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是Ag2O>H2O2>K2CrO4 | |
| B. | H2O2既体现氧化性又体现还原性的反应是①③ | |
| C. | H2O2仅体现氧化性的反应是② | |
| D. | H2O2仅体现还原性的反应是③ |