题目内容
5.在短周期元素中:①金属性最强的元素是Na,②与水反应最剧烈的非金属是F2;在11~18号的元素中,③原子半径最小的元素是Cl;④元素最高价氧化物中既能与盐酸反应又能与烧碱反应,该氧化物是Al2O3.
分析 短周期元素中,Na的金属性最强,F的非金属性最强,电子层数相同时,核电荷数越少半径越大,元素最高价氧化物中既能与盐酸反应又能与烧碱反应,是两性氢氧化物氢氧化铝,以此来解答.
解答 解:短周期元素中,①Na的金属性最强,②F的非金属性最强,则与水反应最剧烈的非金属单质是F2,③在11~18号的元素中,原子半径最小的元素是Cl,元素最高价氧化物中既能与盐酸反应又能与烧碱反应,是两性氢氧化物氢氧化铝,所以对应的元素的氧化物是Al2O3,故答案为:①Na;②F2;③Cl; ④Al2O3.
点评 本题考查元素周期表及元素周期律,为高频考点,把握元素的位置、金属性和非金属性的比较为解答的关键,注意短周期、第三周期元素的性质,题目难度不大.

练习册系列答案
相关题目
12.在强碱性的无色透明溶液中,能大量共存的离子组是( )
| A. | Mg2+、Na+、NO3-、Cl- | B. | K+、Ba2+、MnO4-、NO3- | ||
| C. | Na+、K+、CO32-、Cl- | D. | Ba2+、Na+、NO3-、Cl- |
13.已知A2-核内有x个中子,A原子的质量数为m,则ngA2-所含电子的总物质的量是(单位:mol)( )
| A. | $\frac{m-x+2}{m-n}$ | B. | $\frac{n-(m-x)}{m}$ | C. | $\frac{n(m-x+2)}{m}$ | D. | $\frac{n(m-x+2)}{m}$ |
17.CO2的资源化利用是解决温室效应的重要途径.以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:NH3+CO2→ +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
 +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )| A. | 分子式为C3H3N3O3 | |
| B. | 分子中只含极性键,不含非极性键 | |
| C. | 属于共价化合物 | |
| D. | 该分子中的N原子采用sp杂化、C原子采用sp2杂化 |
14.2005年诺贝尔化学奖授予在“烯烃复分解反应”研究方面作出贡献的三位科学家.“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程.如两分子烯烃RCH=CHR′用上述催化剂作用会生成两种新的烯烃RCH=CHR和R′CH=CHR′.把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是( )
| A. | C6H5CH2CH=M | B. | CH2=CH2 | ||
| C. | C6H5CH2CH2C6H5 | D. | C6H5CH2CH=CHCH2C6H5 |
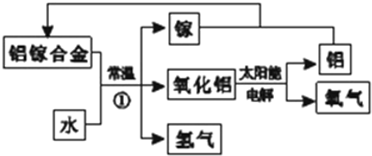 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.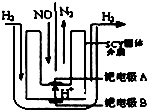 汽车尾气中NOx的消除及无害化处理引起社会广泛关注.
汽车尾气中NOx的消除及无害化处理引起社会广泛关注.