题目内容
【题目】氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3===Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)基态S的价电子排布图为____________。
(2)下列关于物质结构与性质的说法,正确的是________。
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测![]() 的空间构型为______,中心原子S的杂化方式为________,[Ag(S2O3)2]3-中存在的化学键有________(填字母)。
的空间构型为______,中心原子S的杂化方式为________,[Ag(S2O3)2]3-中存在的化学键有________(填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
元素 | Al | Si | P | S | Cl |
E1/(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因___________。
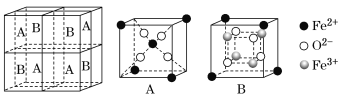
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为_____,已知该晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA,则密度ρ为______g·cm-3(用含a和NA 的代数式表示)。
【答案】![]() BC 四面体 sp3 BCE P的价电子排布式为 3s23p3,3p半充满状态,相对稳定不易结合一个电子 Fe3O4
BC 四面体 sp3 BCE P的价电子排布式为 3s23p3,3p半充满状态,相对稳定不易结合一个电子 Fe3O4 ![]()
【解析】
(1)硫(S)位于元素周期表第三周期,第ⅥA族,价电子排布式为:3s23p4,价电子排布图为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)A.玻尔原子结构模型能够成功地解释氢原子光谱,故A错误;
B.非金属性越强电负性越大,故O>Br>S,故B正确;
C.Mg原子3s轨道为全充满稳定状态,半径又较小,第一电离能高于Na的,它们失去1个电子后,Na+的最外层排布为2s22p6,Mg+的最外层排布为3s1,Na+是稳定结构,第二电
离能远高于Mg的,故C正确;
D.水分子间存在氢键,故H2O的熔沸点大于H2S的,稳定性属于化学性质,与氢键无关,由共价键决定,故D错误;
故选:BC;
(3)S2O32-中其中1个S原子相当于O原子,中心S原子孤电子对数=(6+2-2×4)/2=0,价层电子对数=0+4=4,微粒空间构型为四面体形,中心S原子采取sp3杂化;[Ag(S2O3)2]3-中Ag+与S2O32-之间形成配位键,S2O32-中S原子之间形成非极性键,S与O原子之间形成极性键,故选BCE,故答案为:四面体;sp3;BCE;
(4)P的价电子排布式为3s23p3,3p能级处于半充满状态,相对稳定,不易结合一个电子,P元素的第一电子亲和能较小而表现异常,故答案为:P的价电子排布式为 3s23p3,3p半充满状态,相对稳定不易结合一个电子;
(5)Fe2+离子处于晶胞的顶点、面心以及A位置立方体的体心,O2-位于A、B小立方体的内部,每个小立方体内部各有4个,Fe3+离子处于晶胞B位置小立方体内部,晶胞中Fe原子数目=4+8×![]() +6×
+6×![]() +4×4=24,O原子数目=4×8=32,故Fe、O原子数目之比为24:32=3:4,故氧化物的化学式为Fe3O4。
+4×4=24,O原子数目=4×8=32,故Fe、O原子数目之比为24:32=3:4,故氧化物的化学式为Fe3O4。
晶胞相当于有8个“Fe3O4”,晶胞质量为8×232/NA,晶体密度为(8×232/NA) ÷(a×10-3)g/cm3=![]() ,故本题答案为:Fe3O4;
,故本题答案为:Fe3O4;![]() 。
。