��Ŀ����
����Ŀ��������Ȩ�������Ȼ������������ҹ���ѧ��ѡ���ڻ�ﯣ�ZrTe2�����黯�ӣ�Cd3As2��Ϊ������֤����ά���ӻ���ЧӦ���������˽���-��Ե���ת�����ش��������⣺
(1)пԭ�ӵļ۵����Ų�ͼ��____________________________________________
(2)�����λ��ͬ���壬H2S�ķֽ��¶ȸ���H2Te������Ҫԭ����________________
(3)Cd2+��NH3�������γ������ӡ�1 mol [Cd(NH3)4]2+��___________mol ��������������������Ԫ�صĵ縺�Դ�С��ϵ�ǣ�_______________________
(4)����±���γɶ���±���AsCl3��AsF3��AsBr3���۵��ɸߵ��͵�����Ϊ________
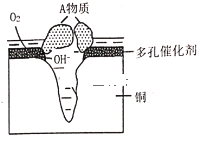
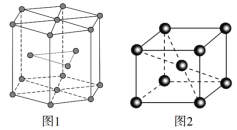
(5)ﯾ�����ͼ1��ʾ�����ֶѻ���ʽ��Ϊ______________________���Ӿ�����ͼ2��ʾ����֪��NA�ǰ����ӵ�������ֵ�������ܶ�Ϊd g��cm3���ڸþ�����������ԭ������˼��Ϊ______nm���ú�NA��d�Ĵ���ʽ��ʾ�����Ӿ�����ԭ�ӿռ�������Ϊ________���ú����Ĵ���ʽ��ʾ����
���𰸡�![]() Sԭ�Ӱ뾶С��Te��H��S���ļ��ܽϴ� 16 N>H>Cd AsBr3>AsCl3>AsF3 �������ܶѻ�
Sԭ�Ӱ뾶С��Te��H��S���ļ��ܽϴ� 16 N>H>Cd AsBr3>AsCl3>AsF3 �������ܶѻ� ![]()
![]()
��������
(1)п��30��Ԫ�أ���ԭ�ӵļ۵����Ų�ͼ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)�����λ��ͬ���壬ͬһ�����������Ԫ�ص�ԭ�Ӱ뾶����������̬�⻯��H2S�еĹ��ۼ�������H2Te�ļ������̣�һ�����Խ�̣�����Խ��ѧ����Խ�ȶ�������H2S�ķֽ��¶ȸ���H2Te���ʴ�Ϊ��Sԭ�Ӱ뾶С��Te��H��S���ļ��ܽϴ�
(3)Cd2+��NH3�������γ������ӡ�1 mol [Cd(NH3)4]2+�к��е� ������ĿΪ4��������ÿ��������������������ÿ����������Cd2+�γ�1����λ��Ҳ���������������![]() mol����������������Ԫ�طֱ�ΪCd��N��H�ĵ縺�Դ�С��ϵΪN>H>Cd���ʴ�Ϊ��16�� N>H>Cd��
mol����������������Ԫ�طֱ�ΪCd��N��H�ĵ縺�Դ�С��ϵΪN>H>Cd���ʴ�Ϊ��16�� N>H>Cd��
(4)����±���γɶ���±���AsCl3��AsF3��AsBr3��Ϊ���ۻ������Ϊ���Ӿ��壬���۵�ĸߵ���Ҫ���ܷ��Ӽ�������Ӱ�죬���ڽṹ���Ƶķ��Ӿ��壬���Ӽ�������������Է������������ȣ��ʴ�Ϊ��AsBr3>AsCl3>AsF3��
(5)ﯾ�����ͼ1��ʾ�����������������ѻ��������ֶѻ���ʽ��Ϊ���������ѻ����Ӿ�����ͼ2��ʾ��1�������к��е���ԭ����ĿΪ��![]() �����辧���ı߳�Ϊacm�����У�
�����辧���ı߳�Ϊacm�����У�![]() ���Ӷ��Ƴ���
���Ӷ��Ƴ��� ���þ�����������ԭ������˼��Ϊ��Խ��ߵ�һ�뼴��
���þ�����������ԭ������˼��Ϊ��Խ��ߵ�һ�뼴��![]() nm���Ӿ�������2����ԭ�ӣ������֮��Ϊ��
nm���Ӿ�������2����ԭ�ӣ������֮��Ϊ��![]() ��������������Ϊ��
��������������Ϊ��![]() ���������������У�
���������������У�![]() ���ռ�������Ϊ��
���ռ�������Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() nm
nm ![]() ��
��

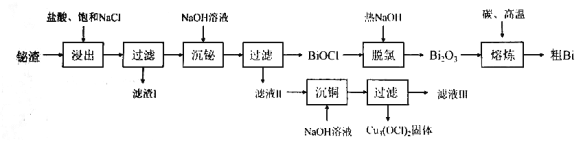
 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�����Ŀ���������γɵĻ���������࣬�ճ�������Ӧ�ù㷺�������������(Na2S2O3)����Ϊ����ҵ�Ķ�Ӱ������Ӧ�Ļ�ѧ����ʽ���£�AgBr��2Na2S2O3===Na3[Ag(S2O3)2]��NaBr���ش��������⣺
(1)��̬S�ļ۵����Ų�ͼΪ____________��
(2)���й������ʽṹ�����ʵ�˵������ȷ����________��
A������ԭ�ӽṹģ���ܹ��ɹ��ؽ�����ԭ�ӹ���
B��Br��S��O����Ԫ�صĵ縺��˳��Ϊ O��Br��S
C��Na�ĵ�һ������С�� Mg������ڶ�������ȴԶ���� Mg
D��ˮ���Ӽ�����������H2O���۷е㼰�ȶ��Ծ�����H2S
(3)����VSEPR�����Ʋ�![]() �Ŀռ乹��Ϊ______������ԭ��S���ӻ���ʽΪ________��[Ag(S2O3)2]3-�д��ڵĻ�ѧ����________(����ĸ)��
�Ŀռ乹��Ϊ______������ԭ��S���ӻ���ʽΪ________��[Ag(S2O3)2]3-�д��ڵĻ�ѧ����________(����ĸ)��
A�����Ӽ� B�����Լ� C���Ǽ��Լ� D�������� E����λ��
(4)��һ��������(E1)��ָԪ�صĻ�̬��̬ԭ�ӵõ�һ�������γ���̬��һ������ʱ���ų�������(��λΪkJ��mol-1)����������Խ��Ԫ��ԭ��Խ�õ��ӡ���֪�������ڲ���Ԫ�ص�һ�����������±���
Ԫ�� | Al | Si | P | S | Cl |
E1/(kJ��mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
����Ԫ�ص�E1������ҳ��������ƣ��Է���PԪ�س����쳣��ԭ��___________��
(5)ij�����������������ᄃ����ͼ��ʾ������A��B��ɡ����������Ļ�ѧʽΪ_____����֪�þ���ľ�������Ϊa nm�������ӵ�������ֵΪNA�����ܶ���Ϊ______g��cm-3(�ú�a��NA �Ĵ���ʽ��ʾ)��

����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ� ��
|
|
|
�� | �� | �� |
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ���ᷢ���˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ