题目内容
2.为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)?CH3OH(g),测定的部分实验数据如下:| t/s | 0 | 500 | 1 000 |
| c(H2)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| c(CO)/mol•L-1 | 2.50 |
(2)在1 000s内用CO表示的化学反应速率是1.26×10-3mol/(L•s),1 000s时CO的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol/L.
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号)ADE;
A.容器内的总压强不随时间而变化
B.反应后混合气体的密度不再发生变化
C.三种气体的浓度相等
D.CH3OH的分解速率与生成速率相等
E.混合气体的平均相对分子质量不再发生变化.
分析 (1)根据表中数据及v=$\frac{△c}{△t}$计算出在500s内用H2表示的化学反应速率;
(2)根据反应速率表达式v=$\frac{△c}{△t}$计算出1000s内用氢气表示的化学反应速率,然后根据化学计量数与反应速率成正比计算出氢气的反应速率;根据反应速率计算出氢气的转化率;
(3)根据氢气的反应速率计算出消耗氢气的物质的量,再计算出在500s时生成的甲醇的浓度;
(4)A.由于该反应为气体体积减小的反应,所以容器内的总压强不随时间而变化,说明反应处于平衡状态;
B.由于该反应是恒容条件下进行,反应前后的气体质量守恒,所以反应过程中混合气体的密度不发生变化;
C.三种气体的浓度相等,不能说明反应是否处于平衡状态,与各物质的起始量有关;
D.CH3OH的分解速率与生成速率相等,即正逆反应速率相等;
E.该反应气体物质的量减小,质量守恒,所以混合气体的平均相对分子质量不再发生变化,说明反应已经处于平衡状态.
解答 解:据化学方程式中的化学计量数之比等于反应速率之比,求算出CO在500s时的浓度为$\frac{3.52}{2}$mol•L-1=1.76mol•L-1,1000s时的浓度为$\frac{2.48}{2}$mol•L-1=1.24mol•L-1,
(1)在500s内用H2表示的化学反应速率为:v(H2)=$\frac{(5.00-3.52)mol/L}{500s}$=2.96×10-3mol/(L•s),
故答案为:2.96×10-3mol/(L•s);
(2)在1000s内用氢气表示的化学反应速率是:v(H2)=$\frac{(5.00-2.48)mol/L}{1000s}$=2.52×10-3mol/(L•s),则1000s内用CO表示的化学反应速率为:v(CO)=$\frac{1}{2}$v(H2)=1.26×10-3mol/(L•s);1000s时CO的消耗浓度为:△c(H2)=(2.500-1.24)mol/L=1.26mol/L,氢气的转化率为$\frac{1.26mol/L}{2.50mol/L}$×100%=50.4%,
故答案为:1.26×10-3mol/(L•s);50.4%;
(3)在500s时氢气的浓度变化为:△c(H2)=(5.00-3.52)mol/L=1.48mol/L,由反应2H2(g)+CO(g)?CH3OH(g)可知,生成甲醇的物质的量浓度为:c(CH3OH)=$\frac{1}{2}$△c(H2)=0.74mol/L,
故答案为:0.74mol/L;
(4)A.由于该反应为气体体积减小的反应,所以容器内的总压强不随时间而变化,说明反应处于平衡状态;
B.由于该反应是恒容条件下进行,反应前后的气体质量守恒,所以反应过程中混合气体的密度不发生变化,所以不能说明反应是否处于平衡状态;
C.三种气体的浓度相等,不能说明反应是否处于平衡状态,与各物质的起始量有关,所以不能说明反应是否处于平衡状态;
D.CH3OH的分解速率与生成速率相等,即正逆反应速率相等,说明反应处于平衡状态;
E.该反应气体物质的量减小,质量守恒,所以混合气体的平均相对分子质量不再发生变化,说明反应已经处于平衡状态;
故选ADE.
点评 本题考查了反应速率的计算、平衡状态的判断,题目难度中等,注意明确化学反应速率与化学计量数成正比,掌握化学反应速率的概念及其表达式.

 名校课堂系列答案
名校课堂系列答案| A. | 2A+2B?3C+D | B. | 3A+2B?2C+D | C. | 2A+B?3C+D | D. | 3A+B?2C+2D |
| A. | 0.1mol•L-1NH4HCO3溶液中:c(NH4+)+c(H+)=c(OH-)+c(HCO3-) | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 欲使Na2S溶液中c(Na+)于c(S2-)的比值恰好为2:1,可加入适量的KHS溶液 |
①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)?CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1
(2)在某温度下,发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ.mol-1
①向某容器中充入1.0molH2O(g)和1.0mol CO(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下表所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
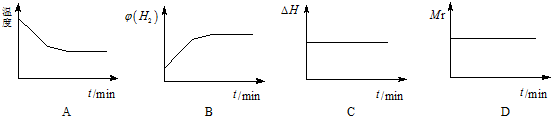
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)(Mr为反应混合物的平均相对分子质量)
(3)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H=-QkJ/mol.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
达到平衡时,CO的转化率为25%.
(4)氨气是重要化工原料,在国民经济中占重要地位.在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.40kJ.mol-1 实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3 n | n | 0 | 放出热量a kJ |
| Ⅱ | 3 n | 2 n | 0 | 放出热量b kJ |
| Ⅲ | 6 n | 2 n | 0 | 放出热量c kJ |
A.N2的转化率:Ⅱ>Ⅰ>ⅢB.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>ⅠD.平衡常数:Ⅲ>Ⅱ>Ⅰ
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 平衡时压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | c1=c3 | B. | a+c/2<90.7 | C. | 2P2>P3 | D. | α1+α3=1 |