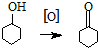题目内容
2.常温下,将amol•L-1CH3COONa溶于水配成溶液,向其中滴加等体积的bmol•L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=$\frac{1{0}^{-7}(a-b)}{b}$.分析 盐酸和醋酸钠之间反应生成氯化钠和醋酸,溶液显示中性,所以醋酸钠会剩余,c(H+)=c(OH-)=10-7mol/L,由于溶液体积加倍,则离子浓度均减半,故c(Cl-)=0.5bmol/L,而根据溶液的电中性可知:c(CH3COO-)+c(Cl-)=c(Na+)=0.5amol/L,所以c(CH3COO-)=(0.5a-0.5b)mol/L,根据醋酸的电离常数表达式来计算.
解答 盐酸和醋酸钠之间反应生成氯化钠和醋酸,溶液显示中性,所以醋酸钠会剩余,则生成的c(CH3COOH)=0.5bmol/L,溶液显中性,故c(H+)=c(OH-)=10-7mol/L,根据电荷守恒,c(Cl-)=0.5bmol/L,c(CH3COO-)+c(Cl-)=c(Na+)=0.5amol/L,所以c(CH3COO-)=(0.5a-0.5b)mol/L,
醋酸的电离常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{(0.5a-0.5b)×1{0}^{-7}}{0.5b}$=$\frac{1{0}^{-7}(a-b)}{b}$,故答案为:$\frac{1{0}^{-7}(a-b)}{b}$.
点评 本题考查了混合溶液中的弱电解质的电离平衡常数的计算,题目难度中等,注意计算过程中的电荷守恒和物料守恒的运用.

练习册系列答案
相关题目
10.下列属于强电解质的是( )
| A. | NH4Cl | B. | NH3•H2O | C. | Cu | D. | CH3CH2OH |
2.为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)?CH3OH(g),测定的部分实验数据如下:
(1)在500s内用H2表示的化学反应速率是2.96×10-3mol/(L•s).
(2)在1 000s内用CO表示的化学反应速率是1.26×10-3mol/(L•s),1 000s时CO的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol/L.
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号)ADE;
A.容器内的总压强不随时间而变化
B.反应后混合气体的密度不再发生变化
C.三种气体的浓度相等
D.CH3OH的分解速率与生成速率相等
E.混合气体的平均相对分子质量不再发生变化.
| t/s | 0 | 500 | 1 000 |
| c(H2)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| c(CO)/mol•L-1 | 2.50 |
(2)在1 000s内用CO表示的化学反应速率是1.26×10-3mol/(L•s),1 000s时CO的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol/L.
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号)ADE;
A.容器内的总压强不随时间而变化
B.反应后混合气体的密度不再发生变化
C.三种气体的浓度相等
D.CH3OH的分解速率与生成速率相等
E.混合气体的平均相对分子质量不再发生变化.

 高温电解技术可将释放的CO2转化为具有工业利用价值的产品.反应方程式为CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,其工作原理示意图如图.电极b上放出的气体X为O2,电极b连接Y为电源的正极(填正、负).
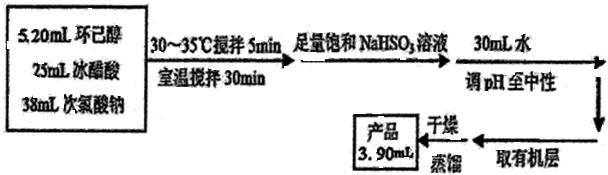
高温电解技术可将释放的CO2转化为具有工业利用价值的产品.反应方程式为CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,其工作原理示意图如图.电极b上放出的气体X为O2,电极b连接Y为电源的正极(填正、负).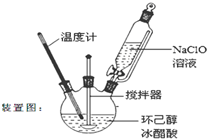 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: