题目内容
19.常温下,溴为橙红色液体,易挥发;碘是略带金属光泽的紫黑色固体,可升华.制取高浓度的碘溶液需将碘溶于KI溶液中,碘酒是碘的酒精溶液.分析 常温下,溴为 橙红色液体,易挥发;碘是紫黑色的固体,卤素单质易溶于有机溶剂中,据此回答.
解答 解:常温下,溴为 橙红色液体,易挥发;碘是紫黑色的固体,将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq),碘酒是碘的酒精溶液.故答案为:橙红、液、紫黑、固、KI溶液、酒精.
点评 本题查学生卤素单质的性质,注意知识的归纳和梳理是解题的关键,难度不大.

练习册系列答案
相关题目
10.下列属于强电解质的是( )
| A. | NH4Cl | B. | NH3•H2O | C. | Cu | D. | CH3CH2OH |
4.将9.5g含有可溶性杂质的MgCl2全部溶于水中配制成溶液,向其中加入足量用稀硝酸酸化的AgNO3溶液,充分反应后,得到沉淀28g,则其中所含杂质不可能是( )
| A. | NaCl | B. | AlCl3 | C. | CaCl2 | D. | FeCl3 |
2.为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)?CH3OH(g),测定的部分实验数据如下:
(1)在500s内用H2表示的化学反应速率是2.96×10-3mol/(L•s).
(2)在1 000s内用CO表示的化学反应速率是1.26×10-3mol/(L•s),1 000s时CO的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol/L.
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号)ADE;
A.容器内的总压强不随时间而变化
B.反应后混合气体的密度不再发生变化
C.三种气体的浓度相等
D.CH3OH的分解速率与生成速率相等
E.混合气体的平均相对分子质量不再发生变化.
| t/s | 0 | 500 | 1 000 |
| c(H2)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| c(CO)/mol•L-1 | 2.50 |
(2)在1 000s内用CO表示的化学反应速率是1.26×10-3mol/(L•s),1 000s时CO的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol/L.
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号)ADE;
A.容器内的总压强不随时间而变化
B.反应后混合气体的密度不再发生变化
C.三种气体的浓度相等
D.CH3OH的分解速率与生成速率相等
E.混合气体的平均相对分子质量不再发生变化.
20.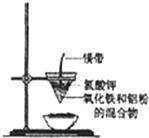 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
(1)氧化铁与铝反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
(2)镁带的作用是燃烧时提供热量,引发反应;氯酸钾的作用是受热分解提供氧气,帮助镁条燃烧.
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
同学们分析数据后推测该熔融物是一种合金,其中的金属是Al、Fe,溶解该合金可选用下列试剂中的BC(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:(1)氧化铁与铝反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
(2)镁带的作用是燃烧时提供热量,引发反应;氯酸钾的作用是受热分解提供氧气,帮助镁条燃烧.
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.

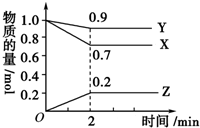 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.
某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.