题目内容
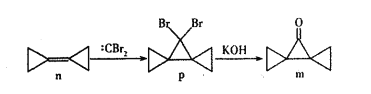
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4 (g)![]() 2NO2 (g)△H,随温度升高,混合气体的颜色变深。回答下列问题:
2NO2 (g)△H,随温度升高,混合气体的颜色变深。回答下列问题:
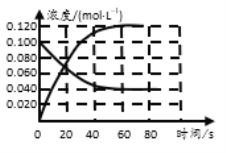
(1)反应的△H ___0(填“﹥”或“﹤”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1,反应的平衡常数K为_______molL-1。
(2)100℃时,在容积为1.00L的容器中,通入1mol NO2(g)和1mol N2O4(g),此时v正_______ v逆(填“>”或“<”或“=”)。
【答案】> 1×10-3 0.36 <
【解析】
(1)随温度升高,混合气体的颜色变深,则表明平衡正向移动,由此得出反应的△H 与0的关系;在0~60s时段,反应速率v(N2O4)为![]() ,反应的平衡常数K为
,反应的平衡常数K为![]() 。
。
(2)100℃时,在容积为1.00L的容器中,通入1mol NO2(g)和1mol N2O4(g),利用浓度商与K进行比较,确定平衡移动的方向,从而确定v正与 v逆的相对大小。
(1)随温度升高,混合气体的颜色变深,则表明平衡正向移动,由此得出反应的△H>0;在0~60s时段,反应速率v(N2O4)为![]() =1×10-3molL-1s-1,反应的平衡常数K为
=1×10-3molL-1s-1,反应的平衡常数K为![]() =0.36molL-1。答案为:>;1×10-3;0.36;
=0.36molL-1。答案为:>;1×10-3;0.36;
(2)100℃时,在容积为1.00L的容器中,通入1mol NO2(g)和1mol N2O4(g),Q=![]() =1>0.36,所以平衡逆向移动,v正<v逆。答案为:<。
=1>0.36,所以平衡逆向移动,v正<v逆。答案为:<。

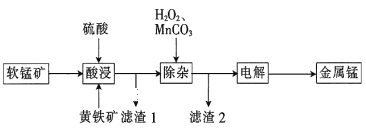
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:
已知相关金属离子[c(Mn+)=0.1molL-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:___。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是___(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是___,该过程需调节溶液pH的范围是___,若把pH调得过高,除了会使锰的产率会降低,其后果还有___。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为___,电解后阳极的电解质溶液可返回___(填“酸浸”“除杂”或“电解”)工序继续使用。