题目内容
20.下列离子方程式书写正确的是( )| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
分析 A.稀硝酸具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子,同时生成NO气体;
B.氢氧化铁比氢氧化镁更难溶,实现了沉淀的转化;
C.溶液为中性时,硫酸氢钠与氢氧化钡的物质的量之比为2:1;
D.强碱性溶液中,反应产物中不会生成氢离子.
解答 解:A.酸性条件下,亚硫酸钠被硝酸氧化生成硫酸钠,离子反应方程式为:3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O,故A错误;
B.向FeCl3溶液中加入Mg(OH)2,氢氧化镁沉淀转化成更难溶的氢氧化铁,反应的离子方程式为:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+,故B正确;
C.NaHSO4溶液与Ba(OH)2溶液反应至中性,氢离子与氢氧根离子的物质的量相等,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C错误;
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,碱性溶液中不会生成氢离子,正确的离子反应为:4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
10.下列说法不正确的是( )
| A. | Na+的结构示意图为 | |
| B. | 纯碱的化学式为Na2CO3 | |
| C. | 在酸性条件下,蔗糖水解的化学方程式为C12H20O11+H2O→2C6H12O6(葡萄糖) | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
5.下列关于化学用语的表示正确的是( )
| A. | 水合氢离子的电子式: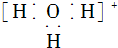 | B. | 氯离子的结构示意图: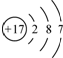 | ||
| C. | 中子数为28的钙原子:2028Ca | D. | 聚丙烯的结构简式: |
12.短周期元素X、Y、Z、W的原子序数依次增大.它们分别位于不同的主族,X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的相等,X与W所在族序数之和等于10.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | W分别与X、Y形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | Z的简单氢化物的热稳定性比W的强 |
7.下列说法正确的是( )
| A. | 重结晶法提纯苯甲酸时,为了析出更多晶体,热滤液要用冰盐水充分冷却 | |
| B. | 自然界中无游离态的Na、K、Si、Fe,有游离态的S、O | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5在空气中不可能形成胶体 | |
| D. | 硅石、玛瑙、硅胶的主要成分是二氧化硅 |

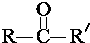 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$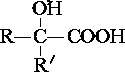 (R、R′代表烃基)
(R、R′代表烃基)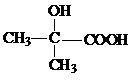 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$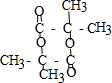 +2H2O.
+2H2O.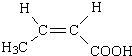 .
. 、
、 、
、 .
.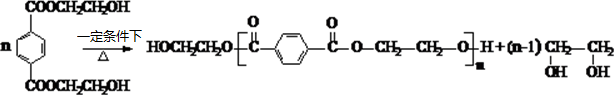 .
.