题目内容
16.无机化合物A主要用于有机合成和药物制造,是具有良好前景的储氢材料.A中含有金属Li元素,遇水强烈水解,对化合物A加强热则其会发生分解反应(非氧化还原反应),生成化合物E和气体C.在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况).已知气体C极易溶于水得到碱性溶液,电解无水B可生成金属单质D和氯气.请回答下列问题:(1)A的化学式是LiNH2,C的电子式是
 .
.(2)写出化合物A与足量盐酸反应的化学方程式:LiNH2+2HCl=LiCl+NH4Cl.
(3)物质A在加强热分解的化学方程式为:3LiNH2$\frac{\underline{\;\;△\;\;}}{\;}$Li3N+2NH3↑.
分析 在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况),气体C极易溶于水得到碱性溶液,可推知C为NH3,电解无水B可生成一种短周期元素的金属单质D和氯气,B为金属D氯化物,4.48L氨气的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,其质量=0.2mol×17g/mol=3.4g,根据质量守恒可知B的质量为2.3g+5.35g-3.4g=4.25g,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,A中含Li,则D为ⅠA族金属,则固体A与NH4Cl固体反应可表为:A+NH4Cl→LiCl+NH3,根据Cl原子守恒,LiCl的物质的量=0.1mol,那么2.3g化合物A中含Li元素也为 0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),则2.3gA中含有N原子为0.2mol-0.1mol=0.1mol,含有H原子为0.2mol×4-0.4mol=0.2mol,可推知A是LiNH2;电解无水B可生成金属单质D和氯气,B为LiCl,则金属D为Li,以此来解答.
解答 解:在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况),气体C极易溶于水得到碱性溶液,可推知C为NH3,电解无水B可生成一种短周期元素的金属单质D和氯气,B为金属D氯化物,4.48L氨气的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,其质量=0.2mol×17g/mol=3.4g,根据质量守恒可知B的质量为2.3g+5.35g-3.4g=4.25g,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,A中含Li,则D为ⅠA族金属,则固体A与NH4Cl固体反应可表为:A+NH4Cl→LiCl+NH3,根据Cl原子守恒,LiCl的物质的量=0.1mol,那么2.3g化合物A中含Li元素也为 0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),则2.3gA中含有N原子为0.2mol-0.1mol=0.1mol,含有H原子为0.2mol×4-0.4mol=0.2mol,可推知A是LiNH2;
(1)由上述分析可知,A为LiNH2,C为氨气,其电子式为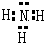 ,故答案为:LiNH2;
,故答案为:LiNH2;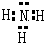 ;
;
(2)化合物A与盐酸反应的化学方程式为LiNH2+2HCl=LiCl+NH4Cl,故答案为:LiNH2+2HCl=LiCl+NH4Cl;
(3)①①物质A在强热条件分解生成氮化锂和氨气,则由元素守恒可知,反应的化学方程式为:3LiNH2$\frac{\underline{\;高温\;}}{\;}$Li3N+2NH3↑,故答案为:3LiNH2$\frac{\underline{\;高温\;}}{\;}$Li3N+2NH3↑;
点评 本题考查无机物推断、化学实验等,题目素材比较陌生,增大题目难度,侧重考查学生对知识的迁移应用与综合分析解决问题能力,对学生的逻辑推理有较高的要求,把握A中含Li元素,则金属D为Li是关键,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 通过煤的液化来提取苯、二甲苯等化工原料 | |
| D. | 工业制液态氧 |
| A. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
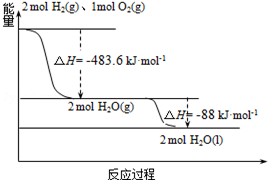 俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)=H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)=O2(l)△H2=-6.84kJ•mol-1
(3)如图:下列说法正确的是( )
| A. | 2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量 |
| A. | 水合氢离子的电子式: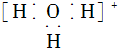 | B. | 氯离子的结构示意图: | ||
| C. | 中子数为28的钙原子:2028Ca | D. | 聚丙烯的结构简式: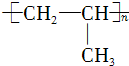 |
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3•H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-可能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |

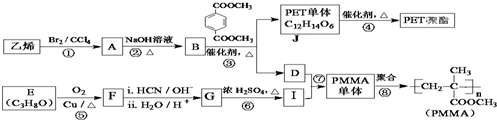
 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$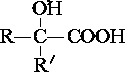 (R、R′代表烃基)
(R、R′代表烃基) $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.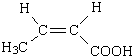 .
.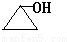 、
、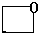 、
、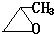 .
.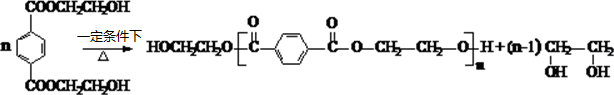 .
.