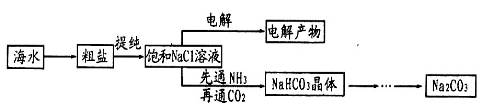
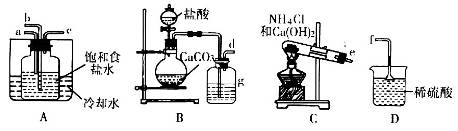
题目内容
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。 
(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是 .稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
方案Ⅱ:称取0.1 g样品置于碘量瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗VmL Na2S2O3溶液。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。方案I中过氧化镁的质量分数为 (用含a、b的表达式表示)。
②方案Ⅱ中滴定前需加入少量 作指示剂;样品中过氧化镁的质量分数为 (用含V的表达式表示)。
(1)①检查装置的气密性 用作催化剂(或催化H2O2的分解)
②消除滴入溶液的体积对所测气体体积的影响
③将右侧刻度管缓缓向下移动直到两侧液面相平
(2)④11 7(a-b)/2a
②淀粉溶液 2.8 V% ’
(第(2)②第一空1分,其余每空2分,本题共15分)
解析试题分析:(1)①该实验是测量气体体积的装置,故实验前要检查装置的气密性;②用恒压分液漏斗的优点为使分液漏斗中的溶液顺利滴下和消除滴入溶液的体积对所测气体体积的影响;③气体的体积受到温度和压强的影响,故读数前要恢复至室温和恢复到常压,即将右侧刻度管缓缓向下移动直到两侧液面相平;(2)①根据前后物质的变化确定质量减少的是氧原子,n(O)=(a-b)/16mol=n(CuO2),过氧化镁的质量分数为②(a-b)/16×56÷a=7(a-b)/2a;②碘参与或生成的反应均采用淀粉溶液做指示剂;方案Ⅱ涉及的反应为
MgO2+2HCl=MgCl2+H2O2
2HCl+H2O2+2KI=2H2O+I2
I2+2Na2S2O3= Na2S4O6+2NaI
所以n(MgO2)=1/2n(Na2S2O3)=0.05×V×10-3mol
样品中过氧化镁的质量分数为=0.05×V×10-3×56/0.1=0.028V
考点:考查物质含量测定中实验操作、条件控制、数据分析等有关问题。

下列不能达到实验目的的是
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Cu( NO3)2的混合液 | 比较确定铜和镁的金属活动性强弱 |
| B | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
下列实验方法正确的是
| A.除去NaCl溶液中的Cl2,可加入酒精后分液 |
| B.滴定管用蒸馏水洗净后,直接装入标准浓度的溶液滴定 |
| C.用排水法收集稀HNO3和Cu反应产生的NO气体 |
| D.用KSCN溶液和氯水鉴别FeCl3溶液中是否含有FeCl2 |
某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙: 。
为了验证可能为甲,请完成下列实验方案。限选试剂:
①98%的浓硫酸 ②1%的品红溶液 ③1.0 mol·L-1的KI-淀粉溶液 ④1.0 mol·L-1 的NaOH溶液 ⑤澄清石灰水 ⑥饱和NaCl溶液
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 (填序号); 试管B中加1%品红溶液; 试管C中加 (填序号)。 | 若___ ___, 则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度(滴定过程涉及的反应有:NaClO + Na2SO3 = NaCl+ Na2SO4 ;2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O)。实验步骤如下:
①量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;
②在使用滴定管之前首先进行的操作是____;将b mol·L-1的酸性KMnO4溶液装入 中;滴定,KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。
③重复滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为 mol·L-1(用含a、b、v1、v2的代数式表示)。

 (3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。