题目内容
某学习小组在实验室模拟侯氏制碱法制备纯碱,其实验流程如下: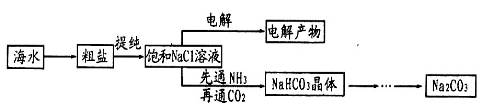
请回答下列问题:
(1)食盐溶液中含SO42-等杂质,不能用于除去SO42-的试剂是_________(填序号)。
a. Ba(OH)2 b.Ba(NO3)2 c. BaCl2 d. Na2CO3
(2)实验制备碳酸氢钠用到下列装置: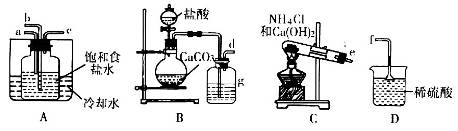
①实验装置中各接口的连接是d接____,e接_____,c接f。实验过程中先通入氨气的原因_____________。
②析出晶体后的溶液中含有大量的NH4+,检验NH4+的方法是__________________。
③瓶g内的溶液是___________________________________________。
(3)由碳酸氢钠制备纯碱的过程中用到的主要仪器除酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(4)用图电解饱和NaC1溶液的方法来制取NaOH、C12和H2。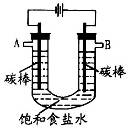
①反应中生成的C12从_______(填“A”或“B”)放出,检验C12所用试剂(用品)______________________。
②经过长时间电解后,向电解液中滴加酚酞试液,发现溶液并未变红色,试分析可能的原因__________。
(14分)(1)bd(2分) (2)①b a(2分);氨气溶解度大,先通入氨气使溶液显碱性,增大CO2的吸收量,增大HCO3-的浓度(2分) ②取适量溶液于试管中,加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝(2分) ③饱和碳酸氢钠溶液
(3)坩埚、坩埚钳(1分)(未答出坩埚钳不给分)
(4)①B(1分);淀粉碘化钾溶液或湿润的淀粉碘化钾试纸(1分)
②电解生成的氯气会与NaOH充分反应,导致电解最终产物仅是NaClO和H2。NaClO具有强氧化性,将酚酞氧化,故溶液不变红色(2分)
解析试题分析:(1)由于在除杂时不能再引入新的杂质,所以要除去食盐溶液中含有SO42-等杂质,可以选择氢氧化钡或氯化钡,而不能选择硝酸钡或碳酸钡,答案选bd。
(2)①根据装置特点可知,A装置是制备碳酸氢钠的,B装置是制备CO2的,C装置是制备氨气的,D装置是吸收多余的氨气。由于氨气极易溶于水,所以氨气要通过a口通入到装置A中,所以正确连接顺序是d接b,e接a,c接f。由于氨气溶解度大,先通入氨气使溶液显碱性,增大CO2的吸收量,从而增大HCO3-的浓度,便于碳酸氢钠晶体析出。
②铵盐能和强碱反应生成氨气,可以通过检验氨气来检验NH4+,所以正确操作是取适量溶液于试管中,加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。
③由于盐酸易挥发,所以生成的CO2中含有氯化氢,而氯化氢能和氨气反应,所以小于除去CO2中的氯化氢气体,因此瓶g内的溶液是饱和碳酸氢钠溶液。
(3)碳酸氢钠加热分解即生成碳酸钠,而固体加热需要在坩埚中进行,所以还缺少的仪器是坩埚和坩埚钳。
(4)①根据装置图可知,A和电源的负极相连,做阴极,溶液中的氢离子放电生成氢气。B和电源的正极相连,做阳极,溶液中的氯离子放电生成氯气,所以氯气在B电极生成。氯气具有强氧化性,能使湿润的淀粉碘化钾试纸变蓝色,据此可以检验氯气,因此检验C12所用试剂(用品)是淀粉碘化钾溶液或湿润的淀粉碘化钾试纸。
②由于电解生成的氯气会与NaOH充分反应,因此长时间电解后会导致电解最终产物仅是NaClO和H2。NaClO具有强氧化性,将酚酞氧化,故溶液不变红色。
考点:考查离子的除杂;碳酸氢钠、CO2和氨气的制备;仪器的选择;NH4+和氯气的检验;电解饱和食盐水的有关判断等

碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验I:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6mol/LHCl或6mol/LH2SO4,其它试剂任选。)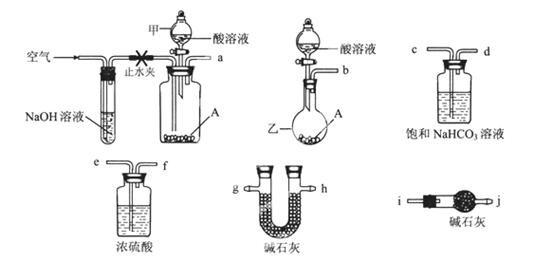
回答下列问题:
(1)仪器乙的名称为________。
(2)请选择必要的装置完成实验II,正确的连接顺序为________ (按气流方向,用接口字母表示);选用的酸溶液是________。
(3)有人提出不采用实验I,可在实验II结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2?3次,将洗涤液过滤,洗涤沉淀2?3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是_________________,实际上未采用该方案的原因是不符合实验设计的________原则(填字母编号)。
| A.科学性 | B.安全性 | C.可行性 | D.简约性 |
(5)通过实验I的相关数据,经计算可得A的摩尔质量为602.0g. mol-1。实验II中称得样品A的质量为9.030g,与足量酸完全反应后,CO2吸收装置增重0.660g,则A 的化学式为________。
(1)某厂利用生产磷铵排放的磷石膏废渣制硫酸联产水泥,硫酸返回用于生产磷铵。其生产流程图如下: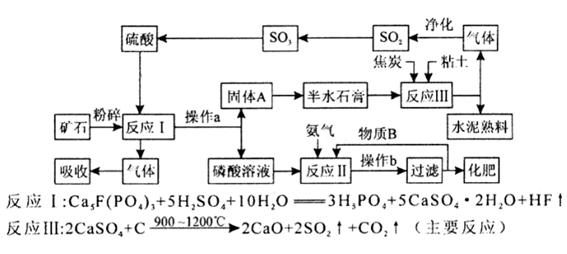
①操作b的名称是浓缩、冷却、 。
②如反应II的产物是两种酸式盐,则物质B中溶质的化学式是 。
③若在实验室中对反应II产生的气体用 吸收。
④该生产流程最大的优点是尽可能地实现原料的循环使用和副产物的综合利用,该生产流程体现的基本思想是 。
(2)为测定同体磷铵化肥中铵态氮的质量分数,实验室用下图所示装置进行实验。实验时,在A中加入mg磷铵样品,关闭止水夹a.打开止水夹b,向A中加入足量的浓NaOH溶液,完全反应后C中浓硫酸增重ng。请回答下列问题: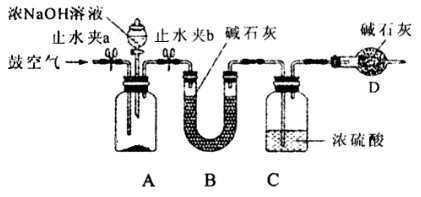
①试说明检查该装置气密性的操作方法和实验现象 。
②装置B的作用是 ,装置D的作用是 。
③实验过程应该在何时鼓入空气?答: (填“开始前”、“过程中”或“反应后”)
④如某次测定的铵态氮的质量分数明显偏低,则可能的原因是 (填字母)。
| A.磷铵样品与氢氧化钠未充分反应 | B.A和B中残留了一定量的氨气 |
| C.氢氧化钠溶液的浓度太大 | D.鼓气过快 |
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因:
。当____
,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 1.10 | 21.10 |
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
化学与生活宙哪相关,下列用选、性质或变化对应正确的是
| A.利用粮食酿酒的化学过程包含:淀粉一→葡萄糖一→己醇 |
| B.在月饼包装袋中放人生石灰:防止食物氧化变质 |
| C.焰火的绚丽:说明只有金属单质能发生焰色反应 |
| D.氢氧化铝用于清疗胃酸过多:氢氧化锯碱性强 |

 杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。