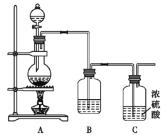
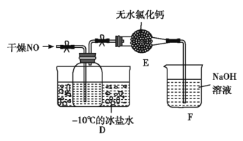
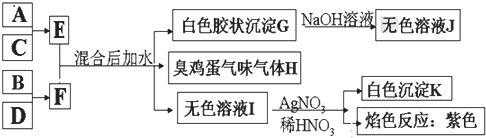
题目内容
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
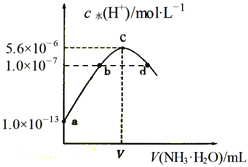
A. V=40
B. c点所示溶液中:c(H+ )-c(OH-)=2c(NH3·H2O)
C. NH3·H2O的电离常数K=10-4
D. d点所示溶液中:c(NH4+)=2c(SO42-)
【答案】D
【解析】试题分析:A、c点水电离程度最大,盐类水解促进水的电离,说明此时c(NH4+)最大,对水的电离促进程度最大,所以两者恰好完全反应生成硫酸铵,氨水体积为0时,水电离出氢离子的浓度为1×10-13mol·L-1,则水电离出的c(OH-)的浓度为1×10-13mol·L-1,溶液中中氢离子的浓度为0.1mol·L-1,稀硫酸的浓度为0.05mol·L-1,所以氨水的体积也是20ml,即V=20,故错误;B、c点所示溶液是硫酸铵溶液,质子守恒得:c(H+)-c(OH-)═c(NH3·H2O),故错误;C、根据题意,无法判断NH3·H2O的电离常数的大小,故错误;D、根据电荷守恒:c(H+)+c(NH4+)═2c(SO42-)+c(OH-),而溶液呈中性c(OH-)═c(H+),所以c(NH4+)═2c(SO42-),故正确。

练习册系列答案
相关题目