题目内容
【题目】酸式盐NaHB在水溶液中,HB﹣的电离程度小于HB﹣的水解程度,下列说法正确的是( )
A.NaHB的存在抑制了水的电离
B.HB﹣水解方程式:HB﹣+H2O![]() H3O++B2﹣
H3O++B2﹣
C.相同物质的量浓度溶液的pH值:NaHB>Na2B
D.溶液中离子浓度大小为:c(Na+)>c(HB﹣)>c(OH﹣)>c(H+)
【答案】D
【解析】
A.HB﹣能电离出氢离子,抑制了水的电离,HB﹣的水解促进了水的电离,但由于HB﹣的电离程度小于HB﹣的水解程度,即HB﹣对水的电离的促进程度大于抑制程度,所以NaHB的存在促进了水的电离,故A错误;
B.该方程式为电离方程式,HB﹣水解方程式:HB﹣+H2O![]() H2B+OH﹣,故B错误;
H2B+OH﹣,故B错误;
C.多元弱酸的盐溶液,第一步水解程度大于第二步,酸根离子水解程度越大,其相同浓度的盐溶液碱性越强,所以相同物质的量浓度溶液的pH:Na2B>NaHB,故C错误;
D.酸式盐NaHB在水溶液中,HB﹣的电离程度小于HB﹣的水解程度,则该溶液中c(OH﹣)>c(H+),溶液呈碱性,钠离子不水解,HB﹣水解,但水解程度较小,所以c(Na+)>c(HB﹣),溶液中离子浓度大小为:c(Na+)>c(HB﹣)>c(OH﹣)>c(H+),故D正确;
故答案为D。

【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
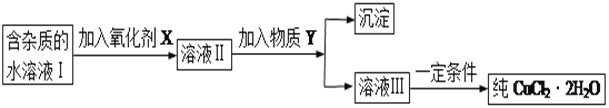
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)