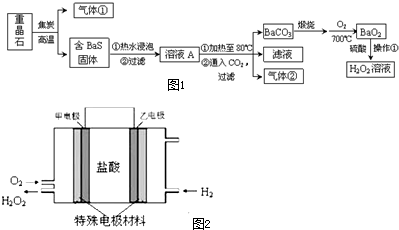
题目内容
9.下列物质露置于空气中不易变质的是( )| A. | 氯水 | B. | 烧碱 | C. | 纯碱 | D. | 漂白粉 |
分析 久置在空气中不易变质,说明该物质性质稳定,不易和空气中物质发生化学反应,据此分析解答.
解答 解:A.氯水中含有次氯酸,次氯酸见光分解而变质,故A不选;
B.烧碱能够吸收空气中水、二氧化碳生成碳酸钠而变质,故B不选;
C.纯碱为碳酸钠,性质稳定,露置于空气中不易变质,故C选;
D.漂白粉主要成分次氯酸钙,与空气中的水、二氧化碳反应生成碳酸钙、次氯酸而变质,故D不选;
故选:C.
点评 本题考查了物质的储存,明确物质的性质是解题关键,注意氯水成分及性质,为高考频考点,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
19.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1molO2与H2的混合气体中含有的分子数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,11.2L N2中含有的原子数目为NA | |
| D. | 标准状况下,22.4L H2O中含有的氧原子数为NA |
17.对于有机物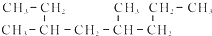 的命名正确的是( )
的命名正确的是( )
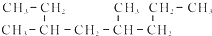 的命名正确的是( )
的命名正确的是( )| A. | 4-甲基-6-乙基庚烷 | B. | 3,5-二甲基辛烷 | ||
| C. | 2-甲基-1,4-二乙基戊烷 | D. | 3,6-二甲基辛烷 |
4.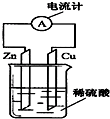 如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录:实验后的记录:①Cu为负极,发生氧化反应; ②H+向负极移动; ③Cu电极上有气泡产生;④电子流动方向是Zn→导线→Cu.描述合理的是( )
如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录:实验后的记录:①Cu为负极,发生氧化反应; ②H+向负极移动; ③Cu电极上有气泡产生;④电子流动方向是Zn→导线→Cu.描述合理的是( )
 如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录:实验后的记录:①Cu为负极,发生氧化反应; ②H+向负极移动; ③Cu电极上有气泡产生;④电子流动方向是Zn→导线→Cu.描述合理的是( )
如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录:实验后的记录:①Cu为负极,发生氧化反应; ②H+向负极移动; ③Cu电极上有气泡产生;④电子流动方向是Zn→导线→Cu.描述合理的是( )| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
14.下列变化中,必须加入氧化剂才能发生的是( )
| A. | NaI→AgI | B. | CO2→CO | C. | Cl2→Ca(C1O)2 | D. | Na→NaOH |
2.质量数为B的Xn- 阴离子含有a个电子,则中子数为( )
| A. | B-a+n | B. | 2B | C. | B-a-n | D. | 2a |