题目内容
20.将23g金属钠投入到100ml水中,使其充分反应,假设反应后溶液的体积不变.试计算:(1)反应后所得溶液溶质的物质的量浓度是多少?
(2)产生标准状况下的气体多少毫升?
(3)所得溶液与0.1mol/LH2SO4溶液恰好完全反应,则需要H2SO4溶液的体积为多少毫升?
分析 (1)钠与水发生反应2Na+2H2O=2NaOH+H2↑,根据n=$\frac{m}{M}$金属Na的物质的量,由方程式计算n(NaOH),再根据c=$\frac{n}{V}$计算形成的氢氧化钠溶液的浓度.
(2)令生成氢气的物质的量为xmol,根据方程式2Na+2H2O=2NaOH+H2↑计算x的值,再根据V=nVm计算氢气的体积;
(3)根据酸碱中和的实质是氢离子和氢氧根离子之间等物质的量的反应来计算即可.
解答 解:(1)0.23g金属钠的物质的$\frac{23g}{23g/mol}$=1mol,
令生成的氢氧化钠的物质的量为ymol,则:
2Na+2H2O=2NaOH+H2↑
2 2
1mol ymol
所以2:2=1mol:ymol,解得y=1mol
故所得氢氧化钠溶液的物质的量浓度为$\frac{1mol}{0.1L}$=10mol/L.
答:反应后所得溶液溶质的物质的量浓度是10mol/L.
(2)令生成氢气的物质的量为xmol,则:
2Na+2H2O=2NaOH+H2↑
2 1
1mol xmol
故2:1=1mol:xmol,解得x=0.5
故标准状况下氢气的体积为0.5mol×22.4L/mol=11.2L=11200mL.
答:产生的氢气在标准状况下的体积为11200mL;
(3)所得溶液与0.1mol/LH2SO4溶液恰好完全反应,设需要H2SO4溶液的体积是V,根据反应关系,得到1mol=0.1mol/L×2×VL,解得V=5L=5000mL,
答:需要H2SO4溶液的体积为5000mL.
点评 本题考查根据方程式的计算、常用化学计量的有关计算等,比较基础,注意基础知识的掌握是重点.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
10.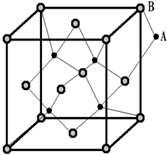 如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )
如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )
 如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )
如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )| A. | AB | B. | A2B | C. | AB3 | D. | A2B3 |
8.类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否.下列几种类推结论中正确的是( )
| A. | 酸的水溶液呈酸性;则有酸性的水溶液也一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 可电解熔融MgCl2来制取金属镁;也能电解熔融HCl来制取氢气 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
15.下列物质的分类合理的是( )
| A. | 碱性氧化物:Na2O、CO、Al2O3、Na2O2 | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 氧化物:Fe2O3、NO、SO2、H2O | D. | 电解质:KNO3、Cl2、HCl、BaSO4 |
5.下列说法正确的是( )
| A. | SO2能使品红溶液褪色 | B. | S在O2中燃烧可生成SO3 | ||
| C. | 用澄清石灰水可鉴别CO2和SO2 | D. | 钠在氧气中燃烧生成氧化钠 |
9.下列物质露置于空气中不易变质的是( )
| A. | 氯水 | B. | 烧碱 | C. | 纯碱 | D. | 漂白粉 |
13.下列各物质的名称不正确的是( )
| A. | 3-甲基-2-戊炔 | B. | 3-甲基-2-丁醇 | C. | 3-甲基-1-丁炔 | D. | 2,2-二甲基丁烷 |