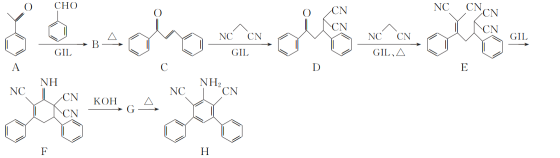
题目内容
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1molCH4和0.1molCl2充分反应,生成的C-Cl键和H-Cl键的数目均为0.2NA
B. 7.8gNa2S和Na2O2的混合物中所含阴离子的数目等于0.2NA
C. 18g固态水(冰)中含有的氢键的数目为2NA
D. 25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中Ag+数目为1.0×10-8NA
【答案】C
【解析】
A.甲烷和氯气在光照条件下发生反应,生成有机物由一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,四步反应同时进行,每种产物的物质的量不确定,且一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷中所含的C-Cl键数目也不相同,则不确定生成的C-Cl键的数目,故A错误;
B.Na2O2中的阴离子是![]() ,Na2S中的阴离子是
,Na2S中的阴离子是![]() ,二者的相对分子质量都是78,所以78g Na2O2和Na2S的混合物中含有的阴离子数目一定是NA,故B错误;
,二者的相对分子质量都是78,所以78g Na2O2和Na2S的混合物中含有的阴离子数目一定是NA,故B错误;
C.依据n=m/M计算物质的量=18g/18g/mol=1mol,氢键是分子间作用力,每个水分子形成两个氢键,18g冰中含有的氢键数目为2NA,故C正确;
D. 25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中c(Ag+)为1.0×10-8mol/L,没给出溶液的体积,故无法计算银离子的数目,故D错误。答案选C。

 励耘书业暑假衔接宁波出版社系列答案
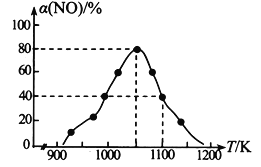
励耘书业暑假衔接宁波出版社系列答案【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
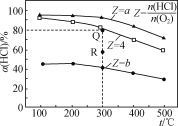
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。

(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为_________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_____________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 18 |
化学式 | _______ | ________ | ________ |