题目内容
【题目】某温度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中![]() 与
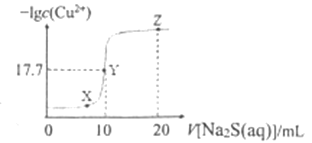
与![]() 溶液体积(V)的关系如图所示,下列说法正确的是( )已知:
溶液体积(V)的关系如图所示,下列说法正确的是( )已知: ![]() 。
。
A. 该温度下 ![]()
B. X、Y、Z三点中,Y点水的电离程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
【答案】B
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,Y点溶液时滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)![]() Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,Ksp(CuS)= c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,据此结合物料守恒分析。
Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,Ksp(CuS)= c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,据此结合物料守恒分析。
A. 该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)= c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,A错误;
B.Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,Y点时恰好形成CuS沉淀,水的电离程度小于X、Z点,所以X、Y、Z三点中,Y点水的电离程度最小,B正确;
C.根据Na2S溶液中的物料守恒可知:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),C错误;
D.向100mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,产生ZnS时需要的S2-浓度为c(S2-)=![]() mol/L=3×10-20mol/L,产生CuS时需要的S2-浓度为c(S2-)=
mol/L=3×10-20mol/L,产生CuS时需要的S2-浓度为c(S2-)= ![]() =10-30.4mol/L<3×10-20mol/L,则产生CuS沉淀时所需S2-浓度更小,即Cu2+先沉淀,D错误;
=10-30.4mol/L<3×10-20mol/L,则产生CuS沉淀时所需S2-浓度更小,即Cu2+先沉淀,D错误;
故合理选项是B。

 名校课堂系列答案
名校课堂系列答案



