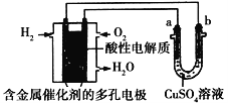
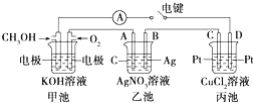
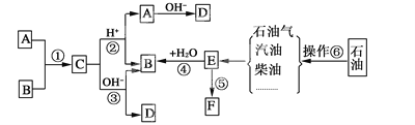
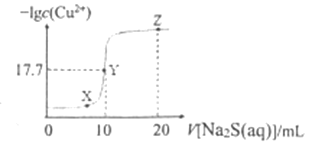
��Ŀ����
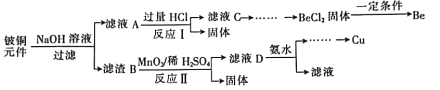
����Ŀ��ijУ��ѧС��ѧ��������ͼ����װ�ý���������ˮ������Ӧ����ʵ�飬�����ò����һ����ȡFeCl3��6H2O���塣(ͼ�мгּ�β������װ�þ�����ȥ)
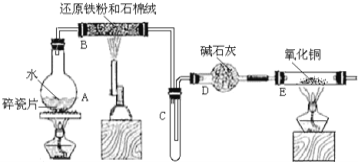
(1)װ��B�з�����Ӧ�Ļ�ѧ����ʽ��__________________________��
(2)װ��E�е�������_____________________________________��
(3) ��С��ѧ������Bװ�õĹ������������ᷴӦ�����Һ��ȡFeCl3��6H2O���壬���������ͼ��ʾ��
![]()
������I��ͨ��Cl2��������______________________________��
�� ����������Һ��Fe3+�IJ�������________________________��
����������FeCl3ϡ��Һ�еõ�FeCl3��6H2O�������Ҫ����������___________��
���𰸡�3Fe+4H2O(g)![]() Fe3O4+4H2 ��ɫ�ķ�ĩ����Ϻ�ɫ���ܱڲ���ˮ�� ��Fe2+������Fe3+ ȡ������Һ�����뼸��KSCN��Һ���۲���Һ�Ƿ���ɫ ����Ũ������ȴ�ᾧ������
Fe3O4+4H2 ��ɫ�ķ�ĩ����Ϻ�ɫ���ܱڲ���ˮ�� ��Fe2+������Fe3+ ȡ������Һ�����뼸��KSCN��Һ���۲���Һ�Ƿ���ɫ ����Ũ������ȴ�ᾧ������
��������
��1������ˮ���������·�Ӧ�����������������������ݴ�д����Ӧ�Ļ�ѧ����ʽ��
��2��װ��E�к�ɫ������ͭ��������ԭ�ɺ�ɫ��ͭ��ͬʱ��ˮ�����ɣ�
��3���ٸ������̽��������ǿ�����Է������������ã�
�ڸ����������ļ��鷽����KSCN��Һ���۲��Ƿ��죻
����FeCl3ϡ��Һ�еõ�FeCl36H2O���������Ũ������ȴ���壬���ˡ�
��1��װ��B��������ˮ�����ڸ����·�����Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe+4H2O(g)![]() Fe3O4+4H2��
Fe3O4+4H2��
��2��װ��B����ˮ������Ӧ���ɵ�����������ʯ�Ҹ�������װ��E������ͭ���������ȷ�����Ӧ������ͭ��ˮ�����Է�Ӧ������Ϊ����ɫ�ķ�ĩ����Ϻ�ɫ���ܱڲ���ˮ�飻
��3��Bװ���з�Ӧ���������Fe3O4��������Feʣ�࣬�����������ᷴӦ����ˣ���Һ�к���FeCl2��FeCl3������Ϊ��������ǿ�����ԣ������ܽ���������������Ϊ���������ӣ��ʴ�Ϊ����Fe2+������Fe3+��
�ڼ�����������KSCN��Һ���۲��Ƿ��죬�ʴ�Ϊ��ȡ������Һ�����뼸��KSCN��Һ���۲���Һ�Ƿ���ɫ��
����FeCl3ϡ��Һ�еõ�FeCl36H2O���������Ũ������ȴ�ᾧ�����ˣ��ʴ�Ϊ������Ũ������ȴ�ᾧ�����ˡ�

����Ŀ��̼���仯�����й㷺����;
(1)�״�����ȼ�ϣ���֪�ڳ��³�ѹ�¼״���ȫȼ�յ��Ȼ�ѧ����ʽ���£�2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ��H1����2mol�״���ȫȼ�����ɶ�����̼����̬ˮʱ��Ӧ����H______��H1(������������������������С����)
(2)ú���ۺ�����ú�����ǽ�ˮ����ͨ�����ȵ�̼����ˮú����C(s)+H2O(g)CO(g)+H2(g) ��H=+131.3kJ��mol��1���ﵽƽ������������ˮú���������ʵĴ�ʩ��______��
A.�����¶� B.����̼������ C.��С��� D.��CO���ռ���ȥCO
(3)һ���¶��£���һ������C(s)��H2O(g)����ij�����ܱ������з���������Ӧ���õ��������ݣ�
�ﵽƽ������ʱ��/s | ��ʼŨ��/ mol��L��1 | ƽ��Ũ��/ mol��L��1 |
H2O(g) | H2(g) | |
10 | 2.0 | 0.6 |
����÷�Ӧ�ӿ�ʼ��ƽ��ʱ����CO��ʾ�ķ�Ӧ����Ϊ______��H2O(g)��ת����Ϊ______��
(4)���п���˵����ӦC(s)+H2O(g)CO(g)+H2(g)�Ѿ��ﵽƽ��״̬����____��
A.��λʱ��������nmolH2��ͬʱ������nmolCO
B.��Ӧ���ʣ� (H2)= (CO)= (H2O)
C.c(H2O):c(CO):c(H2)=1:1:1
D.�¶Ⱥ����һ��ʱ�����������ܶȲ��ٱ仯
E.�¶Ⱥ����һ��ʱ�������ڵ�ѹǿ���ٱ仯