题目内容
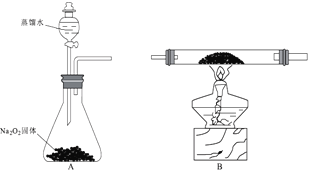
【题目】实验室制取乙烯并检验乙烯性质的装置如下图。
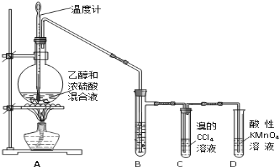
请回答有关问题:
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是_________________;
(2)烧瓶中产生乙烯的反应方程式为:_________________,反应类型为:_________________;C中发生反应的化学方程式为:_________________,反应类型为:_________________;
(3)反应一段时间后,可观察到D中的现象是:_________________;
(4)B中所装的溶液是:_________________溶液,起的作用是_________________。
【答案】(1)防止暴沸 (2)CH3CH2OH![]() CH2=CH2↑+H2O 消去反应
CH2=CH2↑+H2O 消去反应
Br2+CH2=CH2→BrCH2CH2Br;加成反应 (3)酸性高锰酸钾溶液褪色 (4)NaOH;除去制取乙烯气体产生的杂质SO2和CO2等,避免影响乙烯的性质检验
【解析】
试题分析:(1)反应条件是加热到170℃,因乙醇的沸点低,易暴沸,在圆底烧瓶中放2-3块碎瓷片的目的是防止暴沸;
(2)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生消去反应,所以实验室制取乙烯的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O,乙烯含有碳碳双键,能和溴发生加成反应Br2+CH2=CH2→BrCH2CH2Br,生成1,2-二溴乙烷褪色;
CH2=CH2↑+H2O,乙烯含有碳碳双键,能和溴发生加成反应Br2+CH2=CH2→BrCH2CH2Br,生成1,2-二溴乙烷褪色;
(3)乙烯分子中含有碳碳双键,能使酸性高锰酸钾溶液褪色,因此反应一段时间后,可观察到D中的现象是:酸性高锰酸钾溶液褪色;(4)反应中挥发出的乙醇、乙酸和其它副产物气体(如乙醚、SO2和CO2等),干扰检验乙烯性质实验,因此可用10%的NaOH溶液吸收。

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g)![]() 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。
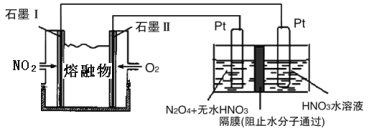
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
【题目】(1)锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH(难溶于水),回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
①普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。该电池中,负极材料主要是________,正极发生的主要反应式是 。
加碱调节溶液pH,使溶液中氢氧根离子浓度达到 mol/L,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。继续加碱调节pH为 ,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
(2)在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO+5C2O+16H+![]() 2Mn2+(溶液无色)+10CO2↑+8H2O。
2Mn2+(溶液无色)+10CO2↑+8H2O。
①若将W g Na2C2O4配成100 mL标准溶液,移取20.00 mL置于锥形瓶中,则酸性KMnO4溶液应装在__________(填“酸式”或“碱式”)滴定管中。本次滴定 选择指示剂(填“需要”、“不需要”)。判断滴定达终点的现象是____ ___。
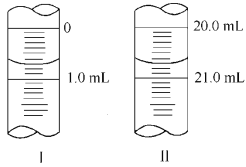
②若滴定管起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为_ (填表达式)。
③若滴定完毕立即读数,测定的KMnO4溶液的浓度___(填“偏高”、“偏低”或“不变”)。