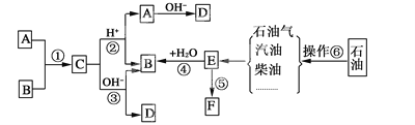
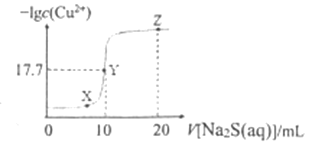
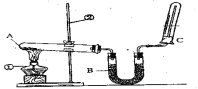
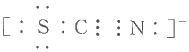题目内容
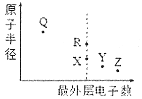
【题目】X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图所示。R原子最外层电子数Q原子最外层电子数的4倍,Q的简单离子核外电子排布与Z2-相同。下列相关叙述不正确的是
A. 化合物![]() 中含有离子键
中含有离子键
B. 五种元素中Q的金属性最强
C. 气态氢化物的稳定性:![]()
D. 最高价氧化物对应的水化物酸性:![]()
【答案】A
【解析】
X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,R原子最外层上的电子数是Q原子最外层电子数的4倍,则Q只能处于IA族,R处于ⅣA族,R与X最外层电子数相同,二者同主族,且R的原子半径较大,故X为C元素、R为Si元素;最外层电子数Z>Y>4,且二者原子半径小于碳原子,故Y、Z处于第二周期,Z能够形成离子Z2-,故Z为O元素,则Y为N元素;Q离子核外电子排布与O2-相同,且Q处于IA族,故D为Na,据此进行解答。
根据上述分析可知X是C元素,Y是N元素,Z是O元素,R是Si元素,Q是Na元素。
A.化合物XZ2是CO2,该物质是共价化合物,由分子构成,分子中含有共价键,A错误;
B.在上述五种元素中只有Q表示的Na元素是金属元素,因此五种元素中Q的金属性最强,B正确;
C.元素的非金属性越强,其简单氢化物的稳定性就越强。由于元素的非金属性N>C,所以氢化物的稳定性NH3>CH4,C正确;
D.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。由于元素的非金属性N>Si,所以酸性:HNO3>H2SiO3,D正确;
故合理选项是A。

【题目】甲醇是应用广泛的化工原料和前景乐观的无色液体燃料。请按要求回答下列问题。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
物质 | CH3OH(l) | CO(g) | H2(g) |
燃烧热/(kJ/mol) | 726.8 | 283.0 | 285.8 |
写出由CO和H2反应生成CH3OH(l)的热化学方程式: _________________________。
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。

①从反应开始至5min时,用CH3OH表示的反应平均速度为____________。
②图中反应达平衡时,K=_______(mol/L)-2;CO的平衡转化率为________________。
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为____________________。

若用该电池及惰性电极电解2L饱和和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为________。
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合游学中两溶质的物质的量之比n(HCOOH):n(HCOONa)____________。