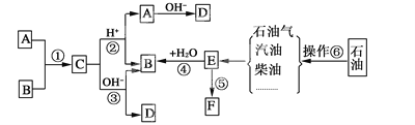
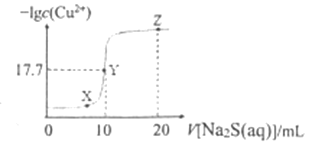
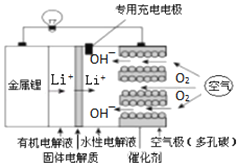
题目内容
【题目】将标准状况下6.72LHCl溶于水配成100mL溶液,取该溶液40mL与一定量的碳酸钙恰好完全反应。计算:
(1)此盐酸的物质的量浓度。(写出计算过程,下同)_____________________
(2)参与反应的碳酸钙的质量是多少?_________________
【答案】n(HCl)=![]() ,c(HCl)=
,c(HCl)=![]() M(CaCO3)=100g·mol-1,n(HCl)=3mol·L-1×0.04L=0.12mol,由化学方程式CaCO3+2HCl=CaCl2+CO2↑+H2O知,n(CaCO3)= n(HCl)×
M(CaCO3)=100g·mol-1,n(HCl)=3mol·L-1×0.04L=0.12mol,由化学方程式CaCO3+2HCl=CaCl2+CO2↑+H2O知,n(CaCO3)= n(HCl)×![]() = 0.12mol×
= 0.12mol×![]() =0.06mol ,m(CaCO3)=100g·mol-1×0.06mol=6g(计算过程合理即可)。
=0.06mol ,m(CaCO3)=100g·mol-1×0.06mol=6g(计算过程合理即可)。
【解析】
(1)据![]() 进行计算;
进行计算;
(2)CaCO3+2HCl=CaCl2+CO2↑+H2O依据此方程式进行计算;
(1) ![]() ,n(HCl)=
,n(HCl)=![]() ,则
,则 ![]() ;
;
答案为:![]() ;
;
(2)CaCO3+2HCl=CaCl2+CO2↑+H2O,依据此方程式找出关系式列式计算如下: ;
;
答案为:6g。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】甲醇是应用广泛的化工原料和前景乐观的无色液体燃料。请按要求回答下列问题。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
物质 | CH3OH(l) | CO(g) | H2(g) |
燃烧热/(kJ/mol) | 726.8 | 283.0 | 285.8 |
写出由CO和H2反应生成CH3OH(l)的热化学方程式: _________________________。
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。

①从反应开始至5min时,用CH3OH表示的反应平均速度为____________。
②图中反应达平衡时,K=_______(mol/L)-2;CO的平衡转化率为________________。
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为____________________。

若用该电池及惰性电极电解2L饱和和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为________。
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合游学中两溶质的物质的量之比n(HCOOH):n(HCOONa)____________。