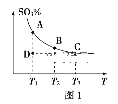
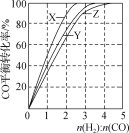
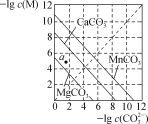
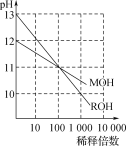
题目内容
【题目】下列有关化学反应速率的理解正确的是( )
A.化学反应速率是指单位时间内任一种反应物浓度的减少或生成物浓度的增加
B.化学反应速率是指某一时刻,某种反应物的瞬时速率
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显
【答案】C
【解析】
A、化学反应速率是指单位时间内某一种反应物浓度的减少或生成物浓度的增加,![]() ,但是不适用于纯固体或者纯液体,A错误;
,但是不适用于纯固体或者纯液体,A错误;
B、化学反应速率是指某一段时间内,某种反应物或者生成物的平均速率,B错误;
C、化学反应速率表示化学反应进行的快慢,C正确;
D、对于化学反应来说,反应速率越大,反应现象并非越明显,比如稀HCl和NaOH溶液的反应,该反应进行得很快,但是观察不到现象,D错误;
故选C。

【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) ___________。
③向NaCN溶液通入少量CO2反应的化学方程式是_____________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____________;此时c(HCN)/c(CN-)=____________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是___________________________。
(3)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol·L-1 Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_____________mol·L-1。