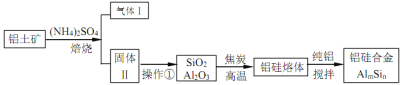
题目内容
【题目】(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________。
②若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=________。
③若反应温度不变,反应物的起始浓度为c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此时v(正)_________v(逆)(填“>”、“<”或“=”)
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
①根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越___。
②对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_______。

③相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:b ________ a (填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
【答案】25% 6 < 小 a、c < < <
【解析】
(1)①根据M的转化率为60%计算出M的浓度变化量,利用浓度变化量之比等于化学计量数之比求出N的浓度变化量,再根据转化率定义计算;
②由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算.
③用浓度商Qc和平衡常数的相对大小,判断正逆反应速率的相对大小;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比②该反应为放热反应,升高温度,平衡逆向移动,则K减小;
②a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,氨气的体积分数小;
b.平衡时浓度不一定相等,平衡只是浓度保持不变的状态;
c.使用催化剂加快反应速率,对平衡无影响;
③恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动。
(1) ①△c(M)=60%×1molL1=0.6molL1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6molL1,故此时N的转化率![]() ×100%=25%,
×100%=25%,
故答案为:25%;
②△c(M)=60%×1molL1=0.6molL1,则:
M(g)+N(g)P(g)+Q(g)
初始(mol/L):1 2.4 0 0
转化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
故该温度下平衡常数k=![]() =0.5,
=0.5,
反应温度不变,反应物的起始浓度分别为c(M)=4molL1,c(N)=amolL1;达到平衡后,c(P)=2molL1,则:
M(g)+N(g)P(g)+Q(g) ;
初始(mol/L):4 a 0 0
转化(mol/L):2 2 2 2
平衡(mol/L):2 a2 2 2
所以平衡常数K=![]() =0.5,解得a=6,
=0.5,解得a=6,
故答案为:6;
③Qc=![]() =
=![]() =1>K=0.5,反应逆向进行,因此v(正)<v(逆),
=1>K=0.5,反应逆向进行,因此v(正)<v(逆),
(2)①该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,
故答案为:小;
②a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;
b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;
c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;
故答案为:ac;
③恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4,
故答案为:<;<;<。

【题目】(1)葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
①写出上述氧化还原反应的化学方程式:___________________
②若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)。
A.=10 mL B.=40 mL C. <10 mL D. >40 mL。
③若滴定终点时PH=8.8,可选择_______为指示剂
④滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)__________________________
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动