题目内容
【题目】(1)基态Fe2+的核外电子排布式为_______________,基态Ti3+的未成对电子有_____个。
(2)1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为________________
(3)有机物 HCHO的VSEPR构型为_______________。(填名称)
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的轨道杂化类型为_________、____________
(5)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,请根据实验现象写出有关反应的离子方程式______________; ________。
(6)已知:下列物质断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
共价键 | H﹣H | N﹣H | N≡N |
能量变化/kJmol﹣1 | 436 | 390.8 | 946 |
则合成氨反应:N2(g)+3H2 (g)=2NH3(g)△H=_________kJmol﹣1
【答案】[Ar]3d6 或 1s22s22p63s23p63d6 1 8NA 平面三角形 sp2 sp3 Cu2++2NH3H2O=Cu(OH)2↓+2NH4+; Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣ -90.8
【解析】
(1)Fe为26号元素,核外电子排布式为1s22s22p63s23p63d64s2,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6,Ti元素为22号元素,核外电子排布式为1s22s22p63s23p63d24s2,基态Ti3+的核外电子排布式为1s22s22p63s23p63d1未成对电子有1个。
答案为:[Ar]3d6 或 1s22s22p63s23p63d6 ;1 ;
(2)1个(CO)中含有1个σ键,4个(CO)中含有4个σ键,4个(CO)与Ni 结合形成4个σ键,故一个[Ni(CO)4]2+中含有8个σ键;1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为8NA ;
答案为:8NA;
(3)有机物 HCHO的中心原子是碳原子,其价电子对数为3,采用sp2杂化,共4个原子,VSEPR构型为平面三角形;
答案为:平面三角形;
(4)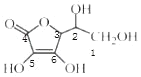 中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;
中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;
故答案为:sp3、sp2;
(5)向硫酸铜中逐滴加入氨水先产生氢氧化铜沉淀,后沉淀溶解生成[Cu(NH3)4]2+,溶液呈深蓝色溶液,反应离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
故答案为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(6)由表中数据可知,N2(g)+3H2(g)=2NH3(g)△H=946kJ/mol+436kJ/mol×32×3×390.8kJ/mol=90.8kJ/mol,
故答案为:90.8。

 阅读快车系列答案
阅读快车系列答案