��Ŀ����
����Ŀ��������ͼװ�����ⶨijԭ��ع���ʱ��ij��ʱ����ͨ�����ߵĵ��ӵ����ʵ�������Ͳ�Ĺ��Ϊ1 000 mL����ѡ��ĵ缫�����д�ͭƬ�ʹ�пƬ��
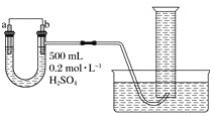
��ش��������⣺
��1��b�缫����Ϊ___����缫��ӦʽΪ____��
��2������Ͳ���ռ���672 mL(��״����)����ʱ��ͨ�����ߵĵ��ӵ����ʵ���Ϊ___mol����ʱa�缫����____(��������������������)___g��
��3�������a��b���缫�ĵ缫���϶Ե���U�ι��н����ֵ�������____��
���𰸡�ͭ 2H����2e��===H2�� 0.06 ���� 1.95 ���Һ���½����Ҷ�Һ������
��������
(1)��ͭƬ�ʹ�пƬ��ϡ�������ԭ���,��ͼ��֪b�缫������������,��bΪͭ,Ϊ����;aΪп,Ϊ����;b�������ӵõ�����������,��缫��ӦʽΪ��2H++2e�TH2����
�ʴ�Ϊ��ͭ;2H++2e�TH2����
(2)����Ͳ���ռ���672mL(��״����)����,��n(H2)=V/Vm=0.672L/22.4L/mol=0.03mol��,��֪b�ϵĵ缫��ӦʽΪ��2H++2e�TH2��,��ͨ�����ߵĵ��ӵ����ʵ���Ϊ0.06mol,a�缫�ϵķ�ӦΪ��Zn2e�TZn2+�����ܽ��Zn�����ʵ���Ϊ0.03mol�����С��Zn������Ϊ65g/mol��0.03mol=1.95g��
�ʴ�Ϊ��0.06����С��1.95��
(3)�����a��b���缫�ĵ缫���϶Ե������ұ�Ϊпʧ���������������ΪͭΪ�����������ӵõ�����������������������������ɣ�����U�ι������Һ���½����Ҷ�Һ��������
�ʴ�Ϊ�����Һ���½����Ҷ�Һ��������

����Ŀ��ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�
�ٽ���ʽ�ζ���������ˮϴ�����ô�����Һ��ϴ����ע�������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦����0���̶����µ�λ�ã����¶���������ƿ������ˮϴ�����ô�����Һ��ϴ��ƿ2��3�Σ��Ӽ�ʽ�ζ����зų�25.00mL������Һ����ƿ�С�
�ڽ���ʽ�ζ���������ˮϴ��������������ע��0.1000mol��L��1�����ᣬ���ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦����0���̶����µ�λ�ã����¶�����
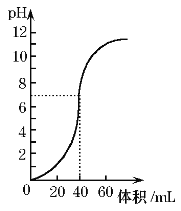
������ƿ�е����̪��ָʾ�������еζ����ζ����յ㣬���������������ΪV1mL��
���ظ����Ϲ��̣����ڵζ�����������ƿ�м���5mL������ˮ�����������������ΪV2mL���Իش��������⣺
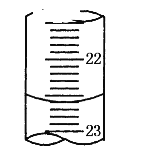
(1)�ζ��յ�ʱ������Ϊ��ƿ�е���Һ��______��
(2)�ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�_______��
(3)��С���ڲ�����еĴ�����______���ɴ���ɵIJⶨ���________(����ƫ��������ƫ����������Ӱ����)��
(4)�����ȱ�ٵIJ�����_____��
(5)����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ___mL��
(6)�����������ݣ�
�ⶨ���� | ����Һ���/mL | ���������/mL | |
�ζ�ǰ����/mL | �ζ������/mL | ||
��һ�� | 25.00 | 0.40 | 20.38 |
�ڶ��� | 25.00 | 4.00 | 24.02 |
���������ռ���Һ�����ʵ���Ũ�ȡ�(��д��������)_______________