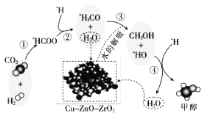
题目内容
【题目】短周期元素W、X、Y和Z的原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y2+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.X的氢化物只含有极性共价键
B.Y单质可通过电解Y的氯化物获得
C.W与氢形成的原子比为1︰1的化合物有多种
D.W与Z形成化合物WZ2中各原子均满足8电子稳定结构
【答案】A
【解析】
W的一种核素在考古时常用来鉴定一些文物的年代,用的是14C,则W为C元素;X2-和Y2+具有相同的电子层结构,X为O元素、Y为Mg元素,Z原子的最外层电子数是其电子层数的2倍,应为S元素,由以上分析可知W为C元素、X为O元素、Y为Mg元素、Z为S元素;
A.X为O元素,与H元素可以形成过氧化氢,过氧化氢的电子式为![]() ,可知过氧化氢中,H元素与O元素形成极性共价键,O元素与O元素形成非极性共价键,因而过氧化氢中既含有极性键也含有非极性键,故A错误;
,可知过氧化氢中,H元素与O元素形成极性共价键,O元素与O元素形成非极性共价键,因而过氧化氢中既含有极性键也含有非极性键,故A错误;
B.Y为镁元素,工业上用电解熔融的氯化镁的方法冶炼镁,故B正确;
C.W为C元素,C元素与H元素可形成苯(C6H6)和乙炔(C2H2)等化合物,它们的C、H原子比为1:1,故C正确;
D.W为C元素,Z为S元素,形成WZ2即CS2,在CS2中C元素显+4价,C元素最外层4个电子,则CS2中C最外层电子数为4+4=8,满足8电子稳定结构,S元素显-2价,S元素最外层电子数为6,则CS2中S最外层电子数为2+6=8,满足8电子稳定结构,因而各原子均满足8电子稳定结构,故D正确;
答案为A。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】(1)基态Fe2+的核外电子排布式为_______________,基态Ti3+的未成对电子有_____个。
(2)1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为________________
(3)有机物 HCHO的VSEPR构型为_______________。(填名称)
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的轨道杂化类型为_________、____________
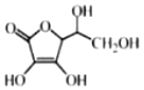
(5)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,请根据实验现象写出有关反应的离子方程式______________; ________。
(6)已知:下列物质断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
共价键 | H﹣H | N﹣H | N≡N |
能量变化/kJmol﹣1 | 436 | 390.8 | 946 |
则合成氨反应:N2(g)+3H2 (g)=2NH3(g)△H=_________kJmol﹣1