题目内容
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.某温度下,78 g ![]() 与适量的
与适量的![]() 恰好完全反应,转移的电子数为
恰好完全反应,转移的电子数为![]()
B.苯与液溴反应生成1 mol溴苯,消耗0.5![]() 个
个![]()
C.![]() 的
的![]() 溶液中,含有
溶液中,含有![]() 的数目为
的数目为![]()
D.100 g 46%的乙醇溶液中,含H—O键的数目为![]()
【答案】A
【解析】
A.2Na2O2+ 2H2O=4NaOH + O2,2Na2O2+ 2CO2=2NaCO3+ O2,每2molNa2O2反应转移2mol电子,某温度下,78 g ![]() (1mol)与适量的
(1mol)与适量的![]() 恰好完全反应,转移的电子数为
恰好完全反应,转移的电子数为![]() ,故A正确;
,故A正确;
B.苯与液溴发生取代反应生成1mol溴苯分子,消耗1molBr2,即为NA个Br2,故B错误;
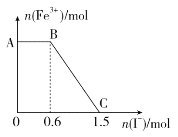
C.根据物料守恒:![]() ,现
,现![]() 的
的![]() 溶液中,含有
溶液中,含有![]() 的数目大于
的数目大于![]() ,故C错误;
,故C错误;
D.水分子中也含有O-H,则100 g 46%的乙醇溶液中,含H—O键的数目大于NA个,故D错误;
故选A。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】(1)基态Fe2+的核外电子排布式为_______________,基态Ti3+的未成对电子有_____个。
(2)1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为________________
(3)有机物 HCHO的VSEPR构型为_______________。(填名称)
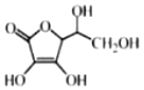
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的轨道杂化类型为_________、____________
(5)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,请根据实验现象写出有关反应的离子方程式______________; ________。
(6)已知:下列物质断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
共价键 | H﹣H | N﹣H | N≡N |
能量变化/kJmol﹣1 | 436 | 390.8 | 946 |
则合成氨反应:N2(g)+3H2 (g)=2NH3(g)△H=_________kJmol﹣1
【题目】下列实验现象和结论或原因相符![]() 是( )
是( )
操作及现象 | 原因或结论 | |
A | 一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落 | 铝的熔点高于三氧化二铝 |
B | 某溶液中先加入稀盐酸,再加入加入硝酸银产生白色沉淀 | 原溶液中一定含有Cl- |
C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
D | 向氢氧化钠溶液中加入适量硫酸亚铁溶液,白色沉淀迅速变成灰绿色,最后变成红褐色 | 生成的氢氧化亚铁沉淀不稳定,容易被氧气氧化成氢氧化铁 |
A.AB.BC.CD.D