��Ŀ����
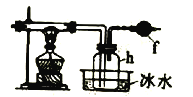
����Ŀ�����������(ZrO2)���Ʊ������մ�(china)����Ҫ��ԭ��֮һ�����Ӣʯ(��Ҫ�ɷ�ΪZrSiO4)�Ʊ�������ﯵĹ���������ͼ��ʾ��
��1��д�������ۡ�ʱ��Ҫ��Ӧ�Ļ�ѧ����ʽ__________________________________��
��2����ˮϴ���������ġ���Һ����Ҫ�ɷ�ΪNaOH ��__________���ѧʽ������д�˳ɷֵ�һ����;________________________________��
��3��д������ֽ⡱����ZrO2+��Ӧ�����ӷ���ʽ__________________________________��
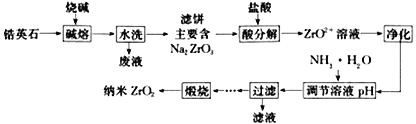
��4������ͼ��1������ZrO2+Ũ�ȶ�ZrO2������Ӱ��_____________________________________��
��5��ZrO2+��Һ�г�����Fe3+��Ũ��Ϊ0.03mol��L-l����һ���ò�����ϴ�����������δ��������ֱ�Ӽ��백ˮ������ҺpH���ܷ�ʹZrO2+��ȫת��Ϊ������ZrO(OH)2��������ͨ������˵������֪ZrO2+��ȫ����ʱŨ��Ϊ1.0��10 -5 mol��L-l ��ZrO(OH)2��Fe(OH)3��Ksp�ֱ�Ϊ4.0��10-26��8.0��10-38�� ![]() ��3.16��__________________________________________________��
��3.16��__________________________________________________��
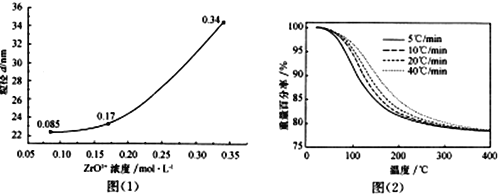
��6��ZrO(OH)2������ȡ����ZrO2ʱ�����������������ٷ���֮��Ĺ�ϵ��ͼ��2����ʾ��
����ʱ�����������Ϊ________________��������______________________��
���𰸡� ZrSiO4+4NaOH==Na2ZrO3+Na2SiO3+2H2O NaSiO3 ճ�ϼ����������ȣ� Na2ZrO3+4H+==2Na++ZrO2++2H2O ZrO2+Ũ��Խ��ZrO2����Խ�� ��ZrO2+��ȫ����ʱ����Ksp[ZrO(OH)2]=c(ZrO2+)��c2 (OH-)==1.0��10-5��c2(OH-)=4.0��10-26��֪c(OH-)==6.32��10-11��Qc[Fe(OH)3]=(Fe3+)��c3(OH-)=0.03��(6.32��10-11)3=7.57��10-33>Ksp[Fe(OH)3]= 8.0��10-38����ʱFe3+�Ѿ���������ˣ���ͨ��������ҺpH�Ƶô�����ZrO(OH) 5��/min ��ʧ����ͬ������£��������ʿ�ʱ���ֽ������¶���Խϸߣ����������𰸾��ɣ�������ͬ�¶��£��������ʸ�ʱ��ʧ�ذٷ���С��
����������1��ZrSiO4��NaOH���ȷ�Ӧ����Na2ZrO3��Na2SiO3����Ӧ�Ļ�ѧ����ʽZrSiO4+4NaOH= ZrSiO4+Na2SiO3+2H2O����ȷ�𰸣�ZrSiO4+4NaOH==Na2ZrO3+Na2SiO3+2H2O��
��2����Ӧ�������ˮ��������ΪNaOH��NaSiO3��NaSiO3����Ҫ��;�������������ϵ�ճ�ϼ����������ȣ�����ȷ�𰸣�NaSiO3��ճ�ϼ����������ȣ���
��3��Na2ZrO3�����������·ֽ�ΪNa2ZrO����Ӧ�����ӷ���ʽΪNa2ZrO3+4H+==2Na++ZrO2++2H2O����ȷ�𰸣�Na2ZrO3+4H+==2Na++ZrO2++2H2O��
��4������ͼ��1��������֪��ZrO2+Ũ��Խ��ZrO2����Խ����ȷ�𰸣�ZrO2+Ũ��Խ��ZrO2����Խ��
��5����ZrO2+��ȫ����ʱ����Ksp[ZrO(OH)2]=c(ZrO2+)��c2 (OH-)==1.0��10-5��c2(OH-)=4.0��10-26��֪c(OH-)==6.32��10-11��Qc[Fe(OH)3]=(Fe3+)��c3(OH-)=0.03��(6.32��10-11)3=7.57��10-33>Ksp[Fe(OH)3]= 8.0��10-38����ʱFe3+�Ѿ���������ˣ���ͨ��������ҺpH�Ƶô�����ZrO(OH) ����ȷ�𰸣������Ƶô�����ZrO(OH)��
6��ͨ��ͼ��2��������֪��������ͬ�¶��£��������ʸ�ʱ��ʧ�ذٷ���С���������ʱ�����������Ϊ5��/min����ȷ�𰸣�5��/min�� ��ʧ����ͬ������£��������ʿ�ʱ���ֽ������¶���Խϸߣ����������𰸾��ɣ�������ͬ�¶��£��������ʸ�ʱ��ʧ�ذٷ���С����

 ������������Ծ�ϵ�д�
������������Ծ�ϵ�д� �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д�����Ŀ����֪ijЩ���ۼ��ļ������±���ʾ�����ȼ���£�N2H4����ȼ�յ��Ȼ�ѧ����ʽ�ǣ�N2H4��g��+O2��g��=N2��g��+2H2O��g����H=��5 akJmol��1��O��H�ļ���Ϊ�� ��
���۽� | N��N | N��H | O=O | N��N |
����kJmol��1 | 3a | 2.5a | 4a | 8a |
A.2a kJmol��1
B.2.5a kJmol��1
C.3a kJmol��1
D.3.5a kJmol��1
����Ŀ�����ݵ���ƽ�ⳣ��(��Ka��ʾ)�Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | HF | H2CO3 | HClO | H2SO3 |
����ƽ�ⳣ��(Ka) | Ka=7.2��10-4 | Ka1=4.2��10-7 Ka2=5.6��10-11 | Ka=3.0��10-8 | Ka1=1.0��10-2 Ka2=5.0��10-8 |
��1��25��ʱ��ͬŨ�ȵ�HF��H2CO3��HClO������Һ�У�pH������____________(д��ѧʽ)��
��2����0.1mol��L-1��HF��Һ1mL��ˮϡ����10mL(�����¶Ȳ���)�����и����������___________(��д��ĸ)��
A��c(H+) B��c(H+)��c(OH-) C��c(H+)/c(HF) D��c(OH-)/c(H+)
��3��25��ʱ���������ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1������������Һ��
��Na2CO3��Һ ��NaHCO3��Һ ��NaF��Һ ��NaClO��Һ��
���������ж���pH�ɴ�С��˳����_________________________(��д���)��
��4������H2SO3�ĵ���ƽ�ⳣ��,����25��ʱ,0.05mol��L-1Na2SO3��Һ��pH=__________��
��ijNa2SO3��NaHSO3�Ļ��Һ�����ԣ�����Һ��c(SO32-)__________c(HSO3-)(����ڡ�����С�ڡ�����")��