题目内容
【题目】单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝,硼,磷等杂质).粗硅与氯气反应生成四氯化硅(反应温度450—500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。
氯气的制取:

(1)实验室用MnO2和浓盐酸制取氯气,若要制得干燥,纯净的氯气,所需装置的接口连接顺序是 ___(填小写字母)。
(2)写出实验室制取氯气的离子方程式:____ 。
(3)装置A中恒压分液漏斗M与常用分液漏斗相比,其优点是 _____,装置D的作用是____。
将上述方法制取的氯气通入下图装置中可以制得四氯化硅。
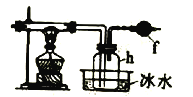
[资料]
a.四氯化硅遇水极易水解
b.硼、铝、铁,磷在高温下均能与氯气直接反应生成相应的氯化物
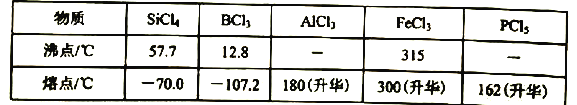
c.有关物质的熔沸点见下表:
(4)装置f中盛放的药品是____,h瓶中左边用粗导管导出物质的目的是____。
(5)从b瓶得到的液体中蒸馏出SiCl4,所需用到的仪器是 ___。
A.容量瓶 B.温度计 C.冷凝管 D.分液漏斗
(6)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 。某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000 × 10-2 mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,滴定终点的现象是____,残留物中铁元素的质量分数是_______。
【答案】 aedih MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 平衡气压,使液体顺利流下 除去氯气中的HCl气体 碱石灰 防止导管堵塞 BC 溶液变为红色,且半分钟内不褪色(或浅紫色等) 4.48%
Mn2++Cl2↑+2H2O 平衡气压,使液体顺利流下 除去氯气中的HCl气体 碱石灰 防止导管堵塞 BC 溶液变为红色,且半分钟内不褪色(或浅紫色等) 4.48%
【解析】(1)实验室用MnO2和浓盐酸制取氯气,生成的氯气中往往含有氯化氢和水蒸气,若要制得干燥,纯净的氯气,需要先用饱和的食盐水除去氯化氢,再用浓硫酸干燥,所需装置的接口连接顺序为aedih,故答案为:aedih;
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)装置A中恒压分液漏斗M与常用分液漏斗相比,其优点是可以平衡气压,使液体顺利流下,装置D中的饱和食盐水可以除去氯气中的HCl气体,故答案为:平衡气压,使液体顺利流下;除去氯气中的HCl气体;
(4) 四氯化硅遇水极易水解,装置f中盛放的药品可以是碱石灰,防止外界空气中的水蒸气进入h,根据表格数据,四氯化硅沸点较低,容易凝华,h瓶中左边用粗导管导出物质,可以防止导管堵塞,故答案为:碱石灰;防止导管堵塞;
(5)从b瓶得到的液体中蒸馏出SiCl4,所需用到的仪器有温度计、冷凝管、蒸馏烧瓶、酒精灯等,故选BC;
(6)用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,MnO4-转变成Mn2+溶液颜色有紫色变成无色,KMnO4标准溶液在酸性条件下进行氧化还原滴定时,不需要指示剂,判断是否达到滴定终点的方法为:当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色,利用关系式法计算:
5Fe2+~~~~~~~~~MnO4-
4×10-3mol 1.000×10-2molL-1×0.02L×![]()
铁元素的质量为:4×10-3mol×56g/mol=2.24×10-1g,铁元素的质量分数![]() ×100%=4.48%,故答案为:溶液变为红色,且半分钟内不褪色;4.48%。
×100%=4.48%,故答案为:溶液变为红色,且半分钟内不褪色;4.48%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案