题目内容
【题目】A部分:由锆英砂(ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)制备ZrO2的流程如下:

已知:①ZrO2在强碱性溶液中以ZrO32-形式存在,在强酸性溶液中以ZrO2+形式存在。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
Mn+ | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.8 | 5.6 | 8.0 |
(1)操作I所需要的玻璃仪器为___________,操作I除了得到溶液a还可得到_________。
(2)加氨水至溶液a中调节pH的的范围是________________。
(3)操作II会得到滤液b和滤渣II,滤渣II分离过程如下:
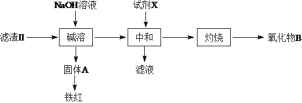
氧化物B的化学式为__________。若试剂X为盐酸,缺点是___________。
(4)操作III除得到Zr(OH)4外还得到某种溶液,向该溶液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为_____________________________。
(5)加入氨水至溶液b发生的离子方程式为__________________________。
(6)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是______________。
B部分:钛精矿是从钛铁矿或钛磁铁矿中采选出来,主要成分为FeTiO3,是生产用途非常广泛的钛白粉的原料。以钛精矿石为原料制备金属钛的流程如下图所示(某些过滤过程已忽略)。已知强酸性溶液中,+4价的钛元素以TiO2+形式存在,金属钛不溶于稀非氧化性酸。回答下列问题:

(1)步骤②中加入铁屑的作用是__________________。
(2)晶体K俗称绿矾,晶体K的化学式为____________。
(3)试写出溶液C加热制备钛酸沉淀的化学方程式__________________________________。
(4)步骤⑥加入过量的活性炭,则发生的化学方程式为_______________,已知TiO2+2Cl2![]() TiCl4+O2为吸热反应,且该条件下反应也能够发生,为何制备TiCl4过程中还要加入活性炭,试解释原因_________________。
TiCl4+O2为吸热反应,且该条件下反应也能够发生,为何制备TiCl4过程中还要加入活性炭,试解释原因_________________。
(5)气体F为氩气,F的作用是_____________________。
(6)溶液H是_________,作用为___________________________。
【答案】烧杯、漏斗、玻璃棒 H2SiO3 5.6~6.2 Al2O3 盐酸的量不易控制 2NH4++CaCO3![]() 2NH3↑+Ca2++CO2↑+H2O ZrO2++2NH3·H2O+H2O=Zr(OH)4↓+2NH4+ 取最后一次洗涤液,加入硝酸酸化的AgNO3,未产生白色沉淀,则洗涤干净 防止Fe2+被氧化 FeSO4·7H2O TiOSO4+2H2O
2NH3↑+Ca2++CO2↑+H2O ZrO2++2NH3·H2O+H2O=Zr(OH)4↓+2NH4+ 取最后一次洗涤液,加入硝酸酸化的AgNO3,未产生白色沉淀,则洗涤干净 防止Fe2+被氧化 FeSO4·7H2O TiOSO4+2H2O![]() H2TiO3↓+H2SO4 TiO2+2Cl2+2C
H2TiO3↓+H2SO4 TiO2+2Cl2+2C![]() TiCl4+2CO 活性炭与O2反应并放热,促进反应正向移动利于制备TiCl4 做保护气 稀盐酸 溶解MgCl2和未反应的Mg,过滤后提纯金属钛
TiCl4+2CO 活性炭与O2反应并放热,促进反应正向移动利于制备TiCl4 做保护气 稀盐酸 溶解MgCl2和未反应的Mg,过滤后提纯金属钛
【解析】
A部分: (1)从反应流程可知,操作I为过滤,所需要的玻璃仪器为烧杯、漏斗、玻璃棒;二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成了胶状沉淀硅酸,因此操作I除了得到溶液a还可得到H2SiO3;综上所述,本题答案是:烧杯、漏斗、玻璃棒,H2SiO3。
(2)加氨水的目的是除去溶液中的铁离子和铝离子,使两种离子变为沉淀,根据表格数据可知,当溶液a中调节pH的的范围是5.6~6.2之间时,即可实现目的;综上所述,本题答案是:5.6~6.2。
(3)滤渣II为氢氧化铁和氢氧化铝混合物,氢氧化铝能够与强碱反应生成偏铝酸钠溶液,偏铝酸钠溶液中加入过量的二氧化碳得到氢氧化铝沉淀,加热氢氧化铝得到氧化铝固体;所以氧化物B的化学式为Al2O3;若试剂X为盐酸,盐酸适量,偏铝酸钠与盐酸反应产生氢氧化铝沉淀,盐酸过量,氢氧化铝沉淀溶解,因此使用盐酸制备氢氧化铝就需控制盐酸的使用量;综上所述,本题答案是:Al2O3;盐酸的量不易控制。
(4)根据流程分析可知,操作III除得到Zr(OH)4外还得到氯化铵溶液,氯化铵溶液水解显酸性,向该溶液中加入CaCO3粉末并加热,得到二氧化碳和氨气。该反应的离子方程式为2NH4++CaCO3![]() 2NH3↑+Ca2++CO2↑+H2O;综上所述,本题答案是:2NH4++CaCO3
2NH3↑+Ca2++CO2↑+H2O;综上所述,本题答案是:2NH4++CaCO3![]() 2NH3↑+Ca2++CO2↑+H2O。
2NH3↑+Ca2++CO2↑+H2O。
(5) 强酸性溶液b中含有ZrO2+,该离子能够与氨水反应生成Zr(OH)4沉淀,离子方程式为:ZrO2++2NH3·H2O+H2O=Zr(OH)4↓+2NH4+;综上所述,本题答案是:ZrO2++2NH3·H2O+H2O=Zr(OH)4↓+2NH4+。
(6)为得到纯净的ZrO2,Zr(OH)4需要洗涤附着的氯化铵溶液,是否洗涤干净,可用稀硝酸和硝酸银溶液检验洗涤液中是否存在氯离子;具体操作如下:取最后一次洗涤液,加入硝酸酸化的AgNO3,未产生白色沉淀,则洗涤干净;综上所述,本题答案是:取最后一次洗涤液,加入硝酸酸化的AgNO3,未产生白色沉淀,则洗涤干净。
B部分: (1) 钛精矿主要成分为FeTiO3,铁为+2价,固体产物A中溶于水后溶液中含有Fe2+,Fe2+易被氧化,因此步骤②中加入铁屑的作用是防止Fe2+被氧化;综上所述,本题答案是:防止Fe2+被氧化。
(2)晶体K俗称绿矾,它为带有7个结晶水的硫酸亚铁晶体,化学式为FeSO4·7H2O;综上所述,本题答案是:FeSO4·7H2O。
(3) C为TiOSO4溶液,加热后生成H2TiO3固体和H2SO4溶液,化学方程式:TiOSO4+2H2O![]() H2TiO3↓+H2SO4;综上所述,本题答案是:TiOSO4+2H2O
H2TiO3↓+H2SO4;综上所述,本题答案是:TiOSO4+2H2O![]() H2TiO3↓+H2SO4。
H2TiO3↓+H2SO4。
(4) 钛酸固体加热分解为TiO2,TiO2与氯气、活性炭反应生成四氯化钛,化学方程式为:TiO2+2Cl2+2C![]() TiCl4+2CO;已知TiO2+2Cl2
TiCl4+2CO;已知TiO2+2Cl2![]() TiCl4+O2为吸热反应,活性炭与O2反应并放热,有利于反应向右移动,提高了四氯化钛的产率;综上所述,本题答案是:TiO2+2Cl2+2C
TiCl4+O2为吸热反应,活性炭与O2反应并放热,有利于反应向右移动,提高了四氯化钛的产率;综上所述,本题答案是:TiO2+2Cl2+2C![]() TiCl4+2CO;活性炭与O2反应并放热,促进反应正向移动利于制备TiCl4。
TiCl4+2CO;活性炭与O2反应并放热,促进反应正向移动利于制备TiCl4。
(5)气体F为氩气,性质稳定,做保护气;综上所述,本题答案是:做保护气。
(6) TiCl4与镁反应生成金属钛和氯化镁,金属钛不溶于稀非氧化性酸;所以H溶液可以选择稀盐酸,溶解MgCl2和未反应的Mg,过滤后提纯金属钛;综上所述,本题答案是:稀盐酸; 溶解MgCl2和未反应的Mg,过滤后提纯金属钛。