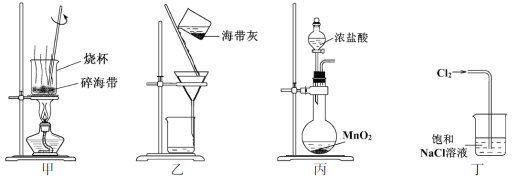
题目内容
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是________。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2 -76.1 ℃,SO3 16.8 ℃;沸点:SO2 -10 ℃,SO3 45 ℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是__________________。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是_____________________;装置Ⅳ的作用是_________________。
③装置Ⅲ中溶液逐渐褪色,说明SO2具有__________性
【答案】H2SO3 2SO2+O2 ![]() 2SO3 使SO3凝结成固体与SO2分离 吸收多余的硫氧化物,避免污染空气 还原
2SO3 使SO3凝结成固体与SO2分离 吸收多余的硫氧化物,避免污染空气 还原
【解析】
(1)将相关的含硫物质依据硫元素化合价分组,依据第三组分类顺序,判断X为+4价的酸为H2SO3 ;
(2)①工业生产中利用SO2的催化氧化制备SO3;
②装置II是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置III中高锰酸钾溶液能氧化二氧化硫生成硫酸;
③SO2有还原性,能被酸性高锰酸钾溶液氧化。
(1)将相关的含硫物质依据硫元素化合价分组,依据第三组分类顺序,判断X为+4价的酸为H2SO3 ;
(2)①工业生产中利用SO2的催化氧化制备SO3,化学方程式为:2SO2+O2 ![]() 2SO3;
2SO3;
②装置II是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置III利用高锰酸钾的强氧化性,吸收硫氧化物,避免污染空气;
③装置III中高锰酸钾溶液紫色褪去,是高锰酸钾氧化二氧化硫生成硫酸的缘故,体现了SO2的还原性。

 53随堂测系列答案
53随堂测系列答案