��Ŀ����
����Ŀ����ѧʵ���Ҳ����ķ�Һ�к��д�������Ⱦ���������ʣ�Ϊ�˱�����������Щ��Һ���뾭����������ŷš�ij��ѧʵ���Ҳ����ķ�Һ�к������ֽ������ӣ�Fe3+��Cu2+����ѧС�����������ͼ��ʾ�ķ����Է�Һ���д������Ի��ս���������������
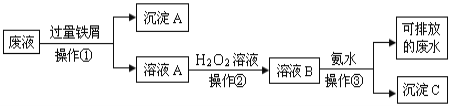
��1�������ٵ�������_______��
��2������A�к��еĽ���������_______��
��3���������й۲쵽��ʵ��������_______��
��4���������з�����Ӧ�����ӷ���ʽΪ_______��
���𰸡����� ����ͭ ��Һ��dz��ɫ��Ϊ�ػ�ɫ Fe3+ + 3NH3��H2O = Fe(OH)3�� + 3NH4+
��������
��Һ�к���Fe3+��Cu2+�����������м��Ӧ����ˣ�����AΪFe��Cu����ҺA�к���Fe2+������˫��ˮ��Fe2+����ΪFe3+���ټ��백ˮ������������������
(1)�������м�������������������Ļ�ѧ���ʱ�ͭ���ã���˿��ѽ���ͭ������Һ���û�������ͬʱFe3+����������������Fe2+��ͨ�����˵õ�����Fe��Cu����ҺA��
(2)������������֪������A�к��н�������ͭ������
(3)Fe2+�ܱ�����������������Fe3+����Һ��dz��ɫ��Ϊ�ػ�ɫ��
(4)��ҺB�к��еĽ���������ΪFe3+����ҺB�м��백ˮ��������ӦFe3++3NH3H2O=Fe(OH)3��+3NH4+��

����Ŀ��ijС��ͬѧ���о�SO2�����ʡ�
��1������صĺ������ʷ�Ϊ���±���ʾ3�飬��2��������X�Ļ�ѧʽ��________��
��1�� | ��2�� | ��3�� |
S(����) | SO2��X��Na2SO3��NaHSO3 | SO3��H2SO4��Na2SO4��NaHSO4 |
��2��������ͼ��ʾ��װ���о�SO2�����ʣ�(�۵㣺SO2 ��76.1 ����SO3 16.8 �����е㣺SO2 ��10 ����SO3 45 ��)
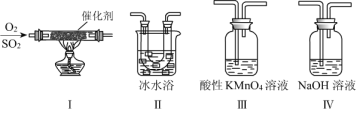
��װ����ģ�ҵ������SO2�������ķ�Ӧ���仯ѧ����ʽ��__________________��
����ͬѧ������������������˳������װ�ã�װ������������_____________________��װ������������_________________��
��װ��������Һ����ɫ��˵��SO2����__________��