题目内容
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是_________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+离子中的大π键应表示为________。
),则EMIM+离子中的大π键应表示为________。

(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
【答案】![]() 哑铃 NH3 氨分子间存在氢键 基态氮原子电子占据的最高能级为半充满,较稳定 sp2、sp3
哑铃 NH3 氨分子间存在氢键 基态氮原子电子占据的最高能级为半充满,较稳定 sp2、sp3 ![]() 原子 4
原子 4 ![]() ×100%
×100%
【解析】
(1)碳原子价电子数为4,价电子排布式为2s22p2,所以价层电子的轨道表达式为![]() ;基态碳原子核外电子占据的最高能级为2p,p的电子云轮廓图为哑铃形;
;基态碳原子核外电子占据的最高能级为2p,p的电子云轮廓图为哑铃形;
(2)NH3中N原子价层电子对个数=3+![]() =4,NO3-中N原子价层电子对个数=3+
=4,NO3-中N原子价层电子对个数=3+![]() ;NO2-中N原子价层电子对个数=2+
;NO2-中N原子价层电子对个数=2+![]() ,所以中心原子价层电子对数不同于其他其他两种粒子的是NH3;NH3比PH3的沸点高是因为氨分子间存在氢键;
,所以中心原子价层电子对数不同于其他其他两种粒子的是NH3;NH3比PH3的沸点高是因为氨分子间存在氢键;
(3)VA族比同周期相邻元素都大,是因为最高能级p轨道上电子数为特殊的半充满状态,能量低、较稳定;
(4)根据图(b)N5-中键总数为5个,根据信息,N5-有6个电子可形成大π键,可用符号Π56表示;
(5)立方氮化硼硬度仅次于金刚石,晶体类型类似于金刚石,是原子晶体;晶胞中每个N原子连接4个B原子,氮化硼化学式BN,所以晶胞中每个B原子也连接4个N原子,即硼原子的配位数为4;晶胞中N原子数为4,B原子数=8×![]() ,晶胞的质量m=
,晶胞的质量m=![]() ,晶胞的体积V=
,晶胞的体积V=![]() =
=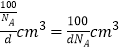 ,B、N原子总体积V`=4×[
,B、N原子总体积V`=4×[![]() ]=
]=![]() cm3,晶胞中原子的空间利用率=
cm3,晶胞中原子的空间利用率=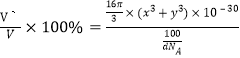 ×100%=
×100%=![]() ×100%。
×100%。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案