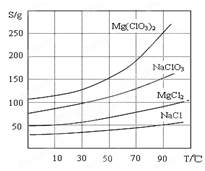
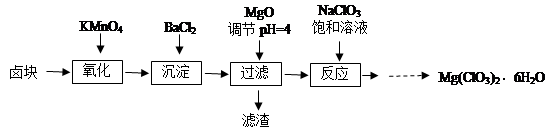题目内容
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示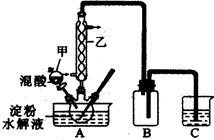
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器乙的名称为:________________________。装置B的作用是 。
(2)检验淀粉是否水解完全的方法:______________________________________________。实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:____________________________________________________。
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;
由此你认为溶液褪色总是先慢后快的原因是_________________________________________。
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4·7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解。向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置。倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干。
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是 。
②用丙酮洗涤固体两次的目的是 。
(1)冷凝管 防C中液体倒吸进A中(安全瓶)
(2)取样,加碘水,看是否变蓝,变蓝则证明水解不完全,否则,完全。
(3)5H2C2O4+2MnO4—+6H+=10CO2+2Mn2++8H2O
(4)Mn2+起了催化剂的作用
(5)①取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
②降低草酸亚铁的溶解量,同时更快洗去表面的水分 (每空2分,共14分)
解析试题分析:(1)三颈烧瓶中产生的二氧化氮气体与水反应,且是加热容器温度较高,故直接把导管插入吸收液中会产生倒吸,装置B是安全瓶,可以防止吸收液倒吸到三颈烧瓶中;(2)若完全水解则溶液中没有淀粉,淀粉用碘水或碘酒等检验,操作时注意取样、操作、现象、结论等步骤;(3)高锰酸钾把草酸氧化为二氧化碳,自己被还原为二价锰离子;(4)实验1,2控制的条件相同,但实验2加入MnSO4反应速率快,故Mn2+起了催化剂的作用;(5)①检验洗涤是否干净需要取最后一次的洗涤液,检验滤液中含有的易检验的离子,但不能是沉淀含有的离子,如氯离子、硫酸根离子等;②用有机溶剂洗涤沉淀同样是除去杂质,无机盐一般不溶解于有机溶剂,故可以降低溶解损失;同时有机溶剂易挥发能更快除去沉淀表面的水。
考点:考查化学综合实验操作、原理等有关问题。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案某研究性学习小组对还原铁粉与水蒸气的反应产物进行科学探究。已知Ca(OH)2的分解温度为580℃,铁粉与水蒸气反应的温度为900℃:根据下图所示实验装置,进行了还原铁粉与水蒸气的反应实验,实验中观察到肥皂液中产生了大量的气泡。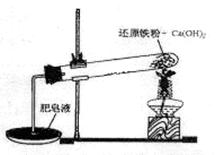
(1)实验中Ca(OH)2的作用是 。实验中产生的气体产物是 。
(2)为进一步探究还原铁粉与水蒸气反应固体产物的成分,研究性学习小组将反应后的固体经处理后得到黑色氧化物固体,针对黑色氧化物固体,该小组提出如下的假设并进行了相关的实验:
假设一:固体为FeO
假设二:固体为Fe3O4
假设三:
①限选用下列试剂:盐酸、KSCN溶液、K3Fe(CN)6 溶液、氯水,证明假设一不成立
| 操作 | 现象 | 结论 |
| | | 假设一不成立 |
②为了进一步确定产物的成分,用黑色固体进行了下列实验:

加入足量氯水所发生反应的离子方程式是 ;检验红褐色固体是否洗涤干净的操作是 ;灼烧时盛放固体的仪器是 ;若假设二成立,黑色固体最终全部转化成的红棕色粉末的质量是 g
实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: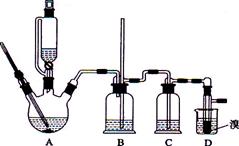
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1) 烧瓶A中发生的主要的反应方程式: 。
(2) 安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞。请写出发生堵塞时瓶B中的现象: 。
(3) 在装置C中应加入 (填字母) ,其目的是
a.水 b.浓硫酸 c.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 洗涤除去。(填字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 。
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
| 实验操作 | 预期实验现象和结论 |
| | 若____________________,假设一成立; 若____________________,假设二成立; 若____________________,假设三成立。 |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
苯甲酸常用于抗真菌及消毒防腐。实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图甲所示(加热、搅拌和仪器固定装置均已略去)。实验过程如下:
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应: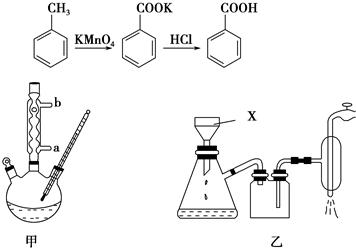
(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
洗涤苯甲酸晶体时应用________洗涤。


 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+