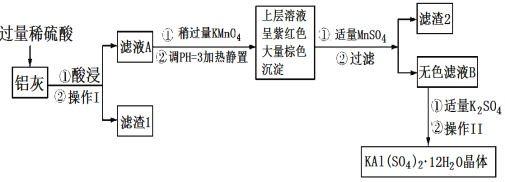
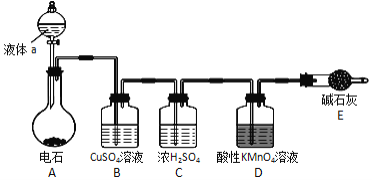
题目内容
【题目】标号为①-⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)②号元素是______![]() 填元素符号
填元素符号![]() ,⑨号元素的离子结构示意图为______
,⑨号元素的离子结构示意图为______
![]() 任写两种
任写两种![]() 。
。
(3)用电子式表示①④号元素形成的最简单化合物的形成过程______
(4)③的最高价氧化物与⑧的单质在点燃条件下发生反应的化学方程式______
(5)①、⑤、⑦号元素形成的化合物的电子式是______,该化合物所含化学键的类型为______
【答案】He  NaOH MgO
NaOH MgO ![]() 2Mg+CO2
2Mg+CO2![]() 2MgO+C
2MgO+C ![]() 离子键和共价键
离子键和共价键
【解析】
由元素周期表结构可知:①为H,②为He,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为S,⑩为Cl,据此解答。
(1)元素②位于第一周期0族,是氦元素,元素符号为He;⑨号元素是硫,硫离子是硫原子得到2个电子后形成的稳定离子,有3个电子层,最外层电子数为8,离子结构示意图为 ;
;
(2)前三周期中,常见的10电子阴阳离子有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等,由这些离子可形成物质如NaOH、MgO、
等,由这些离子可形成物质如NaOH、MgO、![]() 等,它们的阴阳离子均为10电子微粒,故答案为:NaOH;MgO;
等,它们的阴阳离子均为10电子微粒,故答案为:NaOH;MgO;
(3)①是氢元素,④是氮元素,二者形成![]() ,是共价化合物,它们的形成过程为
,是共价化合物,它们的形成过程为![]() ;
;
(4)③是碳元素,最高价化合物是![]() ,⑧是镁元素,即镁在二氧化碳中燃烧,2Mg+CO2
,⑧是镁元素,即镁在二氧化碳中燃烧,2Mg+CO2![]() 2MgO+C;
2MgO+C;
(5)①是氢元素,⑤是氧元素,⑦是钠元素,三者形成NaOH,是离子化合物,电子式为![]()
![]() 其中含有离子键和共价键。
其中含有离子键和共价键。

练习册系列答案
相关题目