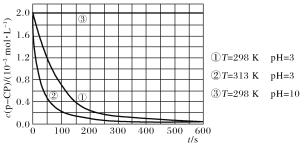
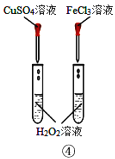
题目内容
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断正确的是( )

A.反应①、②属于氧化还原反应,③属于非氧化还原反应
B.Y的离子半径比Z的离子半径小
C.反应③可以证明X的非金属性强于W
D.一定条件下,x与甲反应生成丁
【答案】D
【解析】
根据题中信息可判断x为碳,丙为二氧化硅,在高温条件下碳与二氧化硅反应生成w为硅、丁为一氧化碳;y2为氧气,碳与氧气点燃反应生成甲为二氧化碳,z为镁,二氧化碳在镁中点燃反应生成碳和乙为氧化镁。
A. 反应①为镁和二氧化碳反应,反应过程镁和碳元素化合价均发生变化,是氧化还原反应,反应②为碳在氧气中点燃,是氧化还原反应,反应③为碳和二氧化硅反应,反应过程中碳和硅元素化合价均发生变化,是氧化还原反应,故A项错误;
B.Y的离子为O2-,Z的离子为Na+,电子层数均为两层,但氧离子的核电荷小于钠离子,故氧离子半径大于钠离子,故B项错误;
C.根据元素周期律,非金属性越强,单质氧化性越强,反应③为:![]() ,反应中C将Si元素还原,不能说明C的非金属性强于Si,故C项错误;
,反应中C将Si元素还原,不能说明C的非金属性强于Si,故C项错误;
D.碳可以和二氧化碳在高温条件下反应生成一氧化碳,故D项正确;
故答案为D。

【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
【题目】标号为①-⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)②号元素是______![]() 填元素符号
填元素符号![]() ,⑨号元素的离子结构示意图为______
,⑨号元素的离子结构示意图为______
![]() 任写两种
任写两种![]() 。
。
(3)用电子式表示①④号元素形成的最简单化合物的形成过程______
(4)③的最高价氧化物与⑧的单质在点燃条件下发生反应的化学方程式______
(5)①、⑤、⑦号元素形成的化合物的电子式是______,该化合物所含化学键的类型为______