题目内容
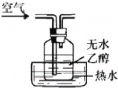
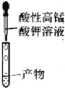
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验。
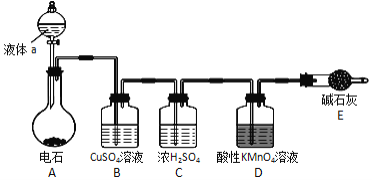
(1)写出实验室制取乙炔的化学方程式:____;
(2)实验室制取乙炔时,分液漏斗中的液体a通常是____;
(3)装置D中的现象是:___;
(4)若D装置中药品为溴水,其生成四溴代物的反应方程式为:____;
(5)工业上常用乙炔、饱和食盐水等物质作原料来合成聚氯乙烯,请写出相关方程式______。
【答案】CaC2+2H2O→C2H2↑+Ca(OH)2 饱和食盐水 酸性高锰酸钾溶液褪色 CH≡CH+2Br2→CHBr2CHBr2 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,Cl2+H2
2NaOH+Cl2↑+H2↑,Cl2+H2![]() 2HCl,CH≡CH+HCl
2HCl,CH≡CH+HCl![]() CH2=CHCl,
CH2=CHCl,
【解析】
实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙,为减慢反应速率,可以用饱和食盐水代替水,反应产生的乙炔气体中混有硫化氢、磷化氢等杂质气体,会对乙炔性质实验造成干扰,可以用硫酸铜溶液进行吸收;乙炔属于不饱和烃,能够与酸性高锰酸钾溶液发生氧化反应,导致其褪色,能与溴水发生加成反应使溴水褪色;聚氯乙烯的单体为CH2=CHCl,CH2=CHCl可由乙炔与HCl发生加成反应获得,所以主要由饱和食盐水制备HCl,据以上分析进行解答。
(1)电石与水反应生成乙炔和氢氧化钙,化学反应方程式为CaC2+2H2O→C2H2↑+Ca(OH)2,故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率,故答案为:饱和食盐水;
(3)乙炔含有碳碳三键,能与高锰酸钾溶液反应,使高锰酸钾溶液褪色,故答案为:酸性高锰酸钾溶液褪色;
(4)溴水与乙炔发生加成反应生成四溴乙烷,反应方程式为CH≡CH+2Br2→CHBr2CHBr2,故答案为:CH≡CH+2Br2→CHBr2CHBr2;
(5)聚氯乙烯的单体是CH2=CHCl,饱和食盐水的作用是电解制取H2和Cl2,Cl2与H2反应得到HCl,乙炔和HCl加成可得到CH2=CHCl,涉及的反应方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,Cl2+H2
2NaOH+Cl2↑+H2↑,Cl2+H2![]() 2HCl,CH≡CH+HCl
2HCl,CH≡CH+HCl![]() CH2=CHCl,
CH2=CHCl, ,故答案为:2NaCl+2H2O
,故答案为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,Cl2+H2
2NaOH+Cl2↑+H2↑,Cl2+H2![]() 2HCl,CH≡CH+HCl
2HCl,CH≡CH+HCl![]() CH2=CHCl,
CH2=CHCl, 。
。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】标号为①-⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)②号元素是______![]() 填元素符号
填元素符号![]() ,⑨号元素的离子结构示意图为______
,⑨号元素的离子结构示意图为______
![]() 任写两种
任写两种![]() 。
。
(3)用电子式表示①④号元素形成的最简单化合物的形成过程______
(4)③的最高价氧化物与⑧的单质在点燃条件下发生反应的化学方程式______
(5)①、⑤、⑦号元素形成的化合物的电子式是______,该化合物所含化学键的类型为______