题目内容
7.氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
(1)该流程中可以循环的物质是氯化钠、氢氧化钠(或NaCl、NaOH).
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果少量Mg2+、Ca2+在电解碱性条件下会生成沉淀,损害离子交换膜.
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).则B处产生的气体是H2,E电极的名称是阳极.
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的离子方程式为SO32-+Cl2+H2O=SO42-+2H++2Cl-.
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得30%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为87.6%.
分析 (1)根据工艺流程图结合电解工艺的原料以及产物知识来判断;
(2)除去钙离子使用碳酸钠试剂,除去镁离子使用氢氧化钠试剂,根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;
(3)电解池中,阳离子移向阴极,根据电极反应确定产物,根据电解池的工作原理来书写方程式;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(5)计算生成NaOH的质量,根据理论耗电量和实际耗电量计算.
解答 解:(1)根据工艺流程图结中用到的原料以及产物,可以知道从阳极槽出来的淡盐水中含有氯化钠可以循环使用,电解产生的氢氧化钠可作为在进入电解槽前需要进行两次精制的原料,也是可以循环使用的物质,
故答案为:氯化钠、氢氧化钠(或NaCl、NaOH);
(2)除去钙离子使用碳酸钠试剂,Ca2++CO32-=CaCO3↓除去镁离子使用氢氧化钠试剂,Mg2++2OH-=Mg(OH)2↓,若食盐水不经过二次精制,处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,碱性条件下会生成沉淀,对装置中的交换膜产生影响,
故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,少量Mg2+、Ca2+在电解碱性条件下会生成沉淀,损害离子交换膜;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的原理方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:H2;阳极;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即Na2SO3+Cl2+H2O=Na2SO4+2HCl,离子反应为:SO32-+Cl2+H2O=SO42-+2H++2Cl-,
故答案为:SO32-+Cl2+H2O=SO42-+2H++2Cl-;
(5)烧碱溶液质量为1.342×103kg/m3×113m3=1.516×105kg,m(NaOH)=1.516×105kg×30%=4.548×104kg,则理论上需要电流量为$\frac{4.548×1{0}^{7}g}{1.492g}$=3.0483×107A,则实际上耗电量为1.45×104A×8×300=3.48×107A,该电解槽的电解效率为$\frac{3.0483×1{0}^{7}}{3.48×1{0}^{7}}$×100%≈87.6%,
故答案为:87.6%.
点评 本题以氯碱工业为载体,考查学生生化学工艺流程题的解题方法知识,注意电解池的工作原理的灵活应用是关键,题目难度中等.

| A. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{NaOH溶液}{→}$Al2O3 | |
| B. | N2$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{O_{2}、H_{2}O}{→}$HNO3 | |
| C. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
| A. | 反应①中的K0H、Cl2和H2都是电解质 | |
| B. | 反应②属于离子反应 | |
| C. | 若反应①消耗7.45gKCl,可以制备标准状况下4.48L氯气 | |
| D. | 反应②中氧化剂和还原剂的质量之比是1:5 |
| A. | 用CO2鉴别NaAlO2溶液和CH3COONa溶液 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用KOH溶液鉴别SO3(g)和SO2 | |
| D. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
甲组:①甘氨酸 ②苯酚 ③醋酸 ④牛油 ⑤甲酸甲酯.
乙组:⑥甲醛 ⑦溴水 ⑧苛性钠溶液 ⑨金属钠 (10)氯化铁溶液.
甲组有一种物质与乙组中的五种物质均能反应;乙组有一种物质与甲组中的五种物质均能反应,则这两种物质分别是( )
| A. | ①⑦ | B. | ①⑧ | C. | ②⑧ | D. | ⑤⑨ |
| A. | 氢气在氯气中燃烧,火焰呈苍白色,瓶口出现大量白雾 | |
| B. | 磷在氯气中燃烧,发出明亮的蓝紫色火焰,产生大量白色烟雾 | |
| C. | 铜在氯气中燃烧,产生白烟,加水溶解后可得蓝绿色溶液 | |
| D. | 用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 |
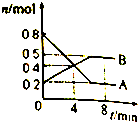 某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,
某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,