题目内容
15.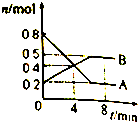 某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,
某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,由图中数据分析:
(1)在密闭容器中反应达到平衡时,A的物质的量是0.2mol,B物质的浓度
是0.25mol•l-1;
(2)该可逆反应的化学方程式为2A?B.
(3)反应开始至4 min时,A的平均反应速率为0.05mol•L-1•min-1.
(4)第4 min时,反应是否达到平衡状态?否(填“是”或“否”).第8 min时,v(正)=v(逆)(填“>”、“<”或“=”)
分析 (1)由图可知,平衡时A的物质的量为0.2mol,B的物质的量为0.5mol,根据c=$\frac{n}{V}$计算B的平衡浓度;
(2)A的物质的量减小、B的物质的量增大,A为反应物、B为生成物,最终A不能完全反应,属于可逆反应,根据物质的量之比等于化学计量数之比确定各物质的系数,进而书写化学方程式;
(3)根据v=$\frac{\frac{△n}{V}}{△t}$计算v(A);
(4)第4 min后A的量继续减小、B的量继续增大,反应向正反应进行;第8 min时,A、B的量不发生变化,处于平衡状态.
解答 解:(1)由图可知,平衡时A的物质的量为0.2mol,B的物质的量为0.5mol,则B的平衡浓度为$\frac{0.5mol}{2L}$=0.25mol/L,故答案为:0.2;0.25;
(2)A的物质的量减小、B的物质的量增大,A为反应物、B为生成物,最终A不能完全反应,属于可逆反应,△n(A):△n(B)=(0.8-0.2)mol:(0.5-0.2)mol=2:1,故反应方程式为:2A?B,故答案为:2A?B;
(3)反应开始至4 min时,A的平均反应速率为$\frac{\frac{0.8mol-0.4mol}{2L}}{4min}$=0.05mol•L-1•min-1,故答案为:0.05;
(4)第4 min后A的量继续减小、B的量继续增大,反应未到达平衡状态,第8 min时,A、B的量不发生变化,处于平衡状态,则v(正)=v(逆),故答案为:否;=.
点评 本题考查化学平衡计算、平衡图象等,比较基础,有利于基础知识的巩固.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
13.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 常温下,pH=1的H2SO4溶液中含有的H+的数目为0.1NA | |
| C. | 标准状况下,2.24L SO3中含有硫原子的数目为NA | |
| D. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA |
14.下列说法中正确的是( )
| A. | 常温下pH=7的溶液中:Fe3+,Mg2+,SO42-,Cl-能大量共存 | |
| B. | 常温下水电离出c(H+)×c(OH-)=10-10的溶液中:Na+,NH4+,CH3COO-,F-不能大量共存 | |
| C. | 在含有HCO3-,HSO3-,CH3COO-,S2-四种阴离子的溶液中加入足够的Na2O2固体后,S2-浓度变化最小 | |
| D. | SO2,O2,HCl,CO2四种气体,可以大量共存于同一容器中 |
20.目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?
CO2(g)+H2(g),得到如下两组数据:
①实验2条件下平衡时H2O 体积分数为20%;
②下列方法中可以证明上述已达平衡状态的是ae;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化 c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化 e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表,则反应CO(g)+H2O(g)?CO2(g)+H2(g),在900K时,该反应平衡常数的对数值(lgK)=0.36.
(3)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H 1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g)△H 2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g)△H 3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
(4)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是0.01mol/L.
(5)25℃时,在20mL0.1mol/L醋酸中加入V mL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.

A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO-)<c(Na+)=0.1mol/L
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:
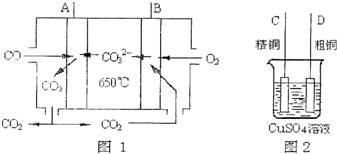
①写出A极发生的电极反应式CO-2e-+CO32-=2CO2 ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与D极(填“C”或“D”)相连.
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
②下列方法中可以证明上述已达平衡状态的是ae;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化 c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化 e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表,则反应CO(g)+H2O(g)?CO2(g)+H2(g),在900K时,该反应平衡常数的对数值(lgK)=0.36.
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
C(s)+O2(g)=CO2(g)△H 1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g)△H 2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g)△H 3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
(4)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是0.01mol/L.
(5)25℃时,在20mL0.1mol/L醋酸中加入V mL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.

A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO-)<c(Na+)=0.1mol/L
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:

①写出A极发生的电极反应式CO-2e-+CO32-=2CO2 ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与D极(填“C”或“D”)相连.
5.下列除杂试剂的选择或除杂操作不正确的是( )
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| B | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| C | FeCl3(FeCl2)溶液 | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4)溶液 | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |


 为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.
为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.