题目内容
16.(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2═6SO2+Fe3O4,若有3mol FeS2参加反应,转移32 mol电子.
(2)在KOH溶液中,用KClO直接氧化Fe(NO3)3即可得K2FeO4:请写出该反应的离子方程式3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O.
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2.
(4)实验室可在空气中熔融氢氧化钾与二氧化锰作用而制备K2MnO4,请写出该反应的化学方程式:4KOH+2MnO2+O2=2K2MnO4+2H2O.
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL 5mol•L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为11.2g.
分析 (1)3FeS2+8O2=6SO2+Fe3O4中,只有O元素的化合价降低,利用化合价计算转移电子;
(2)KClO与Fe3+反应生成K2FeO4和KCl,结合电荷守恒和原子守恒书写;
(3)氯化铁具有氧化性,碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质;
(4)高温条件下,氢氧化钾与二氧化锰、氧气反应生成锰酸钾和水;
(5)铁先与Fe3+反应,然后再与氢离子反应,结合反应的离子方程式计算.
解答 解:(1)3FeS2+8O2=6SO2+Fe3O4中,有3mol FeS2参加反应,8mol氧气参加反应,只有O元素的化合价降低,则转移电子为8mol×2×[0-(-2)]=32mol,
故答案为:32;
(2)在KOH溶液中,KClO与Fe3+反应生成K2FeO4和KCl,反应的离子方程式为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(3)氯化铁具有氧化性,碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,反应离子方程式为:2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(4)高温条件下,氢氧化钾与二氧化锰、氧气反应生成锰酸钾和水,其反应的方程式为:4KOH+2MnO2+O2=2K2MnO4+2H2O;
故答案为:4KOH+2MnO2+O2=2K2MnO4+2H2O;
(5)氢气的物质的量为 0.1mol,
由关系式Fe~~~~2HCl~~~H2,得到
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为$\frac{1}{3}$×(0.16L×5mol/L-0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
点评 本题综合考查氧化还原反应、化学方程式和离子方程式的书写、元素化合物知识等,侧重学生的分析、计算能力的考查,注意把握物质的性质,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 常温下pH=7的溶液中:Fe3+,Mg2+,SO42-,Cl-能大量共存 | |
| B. | 常温下水电离出c(H+)×c(OH-)=10-10的溶液中:Na+,NH4+,CH3COO-,F-不能大量共存 | |
| C. | 在含有HCO3-,HSO3-,CH3COO-,S2-四种阴离子的溶液中加入足够的Na2O2固体后,S2-浓度变化最小 | |
| D. | SO2,O2,HCl,CO2四种气体,可以大量共存于同一容器中 |
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 11种 |
| A. | O2和O3 | B. | CH3CH2CH2CH3和 | C. | 12C和14C | D. | CH4和CH3CH3 |
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| B | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| C | FeCl3(FeCl2)溶液 | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4)溶液 | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 若a=b+c时,B的物质的量分数不变 | B. | 若a<b+c时,A的转化率减小 | ||
| C. | 若a<b+c时,B的物质的量浓度减小 | D. | 若a>b+c时,A的物质的量分数减小 |

 为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.
为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.
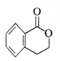
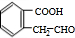
 +H2O$→_{△}^{稀H_{2}SO_{4}}$
+H2O$→_{△}^{稀H_{2}SO_{4}}$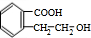 +CH3OH③F→G:2
+CH3OH③F→G:2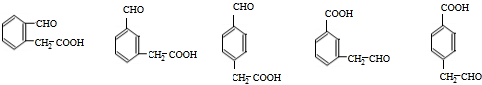 等
等