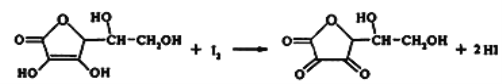题目内容
【题目】在某一化学反应,在一定温度下,反应物A的浓度从3.0 mol/L变为2.0 mol/L需要10秒,则从2.0 mol/L变为1.0 mol/L大概需要 ( )
A. 4秒B. 7秒C. 10秒D. 13秒
【答案】D
【解析】
浓度越小反应速率越慢,反应物A的浓度从3.0 mol/L变为2.0 mol/L需要10秒,则从2.0 mol/L变为1.0 mol/L需要的时间大于10秒,故选D。

【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2 (g)![]() CH3OH(g) △H1;
CH3OH(g) △H1;
②CO2 (g)+3H2 (g)![]() CH3OH(g)+H2O(g) △H=-58kJ/mol;
CH3OH(g)+H2O(g) △H=-58kJ/mol;
③CO2 (g)+H2(g)![]() CO(g)+H2O(g) △H==+41k J/ mol。
CO(g)+H2O(g) △H==+41k J/ mol。
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下表:
化学键 | H—H | C-O | C≡O | H-O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=___________。
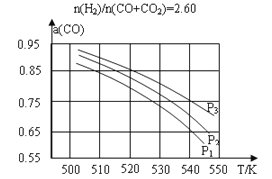
(2)合成气组成n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图甲所示。α(CO)值随温度升高而___________(填“增大”或“减小”),其原因是_____;图中的压强由大到小为___________,其判断理由是_____________。
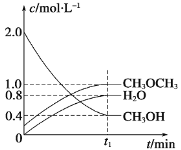
(3)若将1mol CO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
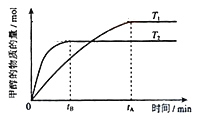
①曲线I、Ⅱ对应的平衡常数大小关系为K1___________KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是___________(填序号)。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=0断裂的同时有6个H-H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为____,该温度下的平衡常数为___________;若容器容积不变,下列措施可增加甲醇产率的是___________。(填序号)。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2