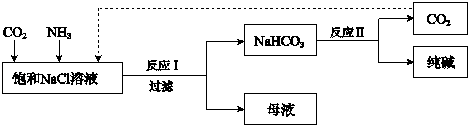
��Ŀ����
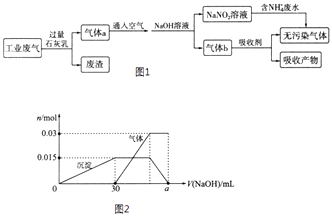
����Ŀ����1��һ���¶����У�a�����ᡡb�����ᡡc��������������Һ���������abc��գ�
���������ʵ���Ũ����ͬʱ��c��H+���ɴ�С��˳����__________��
������pH��ͬʱ�����ʵ���Ũ���ɴ�С��˳��Ϊ_________������ϡ��10����pH�ɴ�С��˳��Ϊ_____________
��2��ij�¶��£���ˮ�е�c (H+)= 4.0��10-7 mol/L, ����¶��´�ˮ�е�c (OH-)=______________mol/L; ���¶Ȳ���, ����ϡNaOH��Һ, ʹc (OH-)= 5.0��10-6 mol/L,����Һ��c (H+)= _________________mol/L.
��3����25��ʱ��100ml 1.0mol/L������������1.2mol/L������������Һ���, ��Ϻ���Һ��pH= _______________
���𰸡� b��a��c c��a��b a = b�� c 4.0��10-7 3.2��10-8 13
�����������������(1).���ᡢ���ᡢ��������������Һ�еĵ���������£�������һԪǿ�ᣬ��ˮ��Һ����ȫ���룬�����ڵ���ƽ�⣺HCl===H++Cl���������Ƕ�Ԫǿ�ᣬ��ˮ��Һ��Ҳ��ȫ���룬�����ڵ���ƽ�⣺H2SO4===2H++SO![]() ��������һԪ���ᣬ��ˮ��Һ�в��ֵ��룬���ڵ���ƽ�⣺CH3COOH
��������һԪ���ᣬ��ˮ��Һ�в��ֵ��룬���ڵ���ƽ�⣺CH3COOH![]() CH3COO��+H+����2����ˮ�е�c(OH��)=c(H��)�����¶Ȳ��䣬ˮ�����ӻ����䣻��3����25��ʱ��100ml 1.0mol/L������������1.2mol/L������������Һ��ϣ�����������ʣ�࣬�ȼ���ʣ�����������ӵ�Ũ�ȣ��ټ���������Ũ�ȣ�
CH3COO��+H+����2����ˮ�е�c(OH��)=c(H��)�����¶Ȳ��䣬ˮ�����ӻ����䣻��3����25��ʱ��100ml 1.0mol/L������������1.2mol/L������������Һ��ϣ�����������ʣ�࣬�ȼ���ʣ�����������ӵ�Ũ�ȣ��ټ���������Ũ�ȣ�
������(1) ��������������ʵ���Ũ�Ⱦ�Ϊx����������c(H+)=c(HCl)=x,������c(H+)=2��c(H2SO4)=2x��������c(H+)����c(CH3COOH)��c(H+)����x����b��a��c������c(H+)=y����������c(H+)=c(HCl)=y��������c(H2SO4)= ![]() c(H+)=
c(H+)=![]() ��������c(H+)����c(CH3COOH)��y����c(CH3COOH)���ɷ�����֪��c(H+)��ͬʱ��c(CH3COOH)���c(HCl)��֮��c(H2SO4)��С����c��a��b��
��������c(H+)����c(CH3COOH)��y����c(CH3COOH)���ɷ�����֪��c(H+)��ͬʱ��c(CH3COOH)���c(HCl)��֮��c(H2SO4)��С����c��a��b��
��2��ij�¶��£���ˮ�е�c(OH��)=c(H��)= 4.0��10-7 mol/L�����¶��£�ˮ�����ӻ���![]() ��c (OH-)= 5.0��10-6 mol/Lʱ�� c (H+)=
��c (OH-)= 5.0��10-6 mol/Lʱ�� c (H+)= ![]() 3.2��10-8 mol/L����3����25��ʱ��100ml 1.0mol/L������������1.2mol/L������������Һ���������������ʣ����ʣ�����������ӵ�Ũ����
3.2��10-8 mol/L����3����25��ʱ��100ml 1.0mol/L������������1.2mol/L������������Һ���������������ʣ����ʣ�����������ӵ�Ũ����![]() ��
�� ![]() ��PH=
��PH=![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�������ǹ�ũҵ�����в��ɻ�ȱ�����ʣ��о���ȡ�����Ļ�������Ƿ���
��1���ڳ��¡���ѹ�����������£�N2�ڲ�������Fe2O3��TiO2����������ˮ�������з�Ӧ:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) ��H=a kJ mol-1 ��
O2(g) ��H=a kJ mol-1 ��
Ϊ��һ���о�����NH3�����ʵ������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������£�
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
�˷�Ӧ��a_________0����S________0�����>����<���� = ����
��2�������¶Ⱥ�ѹǿ�£���2 L�ĺ����ܱ������кϳɰ���:N2(g)+3H2(g)![]() 2NH3(g) ��H=-92.4 kJ mol-1���ڷ�Ӧ�����з�Ӧ�������������ʵ�����ʱ��ı仯��ͼ��ʾ��
2NH3(g) ��H=-92.4 kJ mol-1���ڷ�Ӧ�����з�Ӧ�������������ʵ�����ʱ��ı仯��ͼ��ʾ��
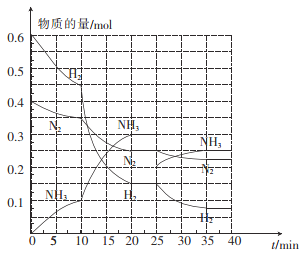
�� 0��10 min�ڣ���NH3��ʾ��ƽ����Ӧ����Ϊ_________��
�� ��10��20 min�ڣ�NH3Ũ�ȱ仯��ԭ�������_______��
A��������� B����С������� C�������¶� D������NH3�����ʵ���
�� �ڷ�Ӧ������25 minʱ�����߷����仯��ԭ����____________���ﵽ�ڶ���ƽ��ʱ����ƽ���ƽ�ⳣ��K2______K1���>����<���� = ����