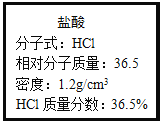
题目内容
【题目】无机化合物可根据其组成和性质进行分类,如下所示:
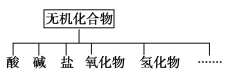
(1)上面所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出实验室由⑩制备O2的化学方程式___________________________________。
【答案】树状分类法 H2SO4(或HNO3或H2CO3等均可) NaOH(或KOH) Na2SO4(或K2CO3或Na2SO3或NaNO3等) 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
【解析】
(1)常见的分类法有两种:交叉法和树状分类法,由图可知为树状分类法;
答案为:树状分类法;
(2)常见的酸有H2SO4、HNO3、HCl等,碱有KOH、NaOH、Ba(OH)2、Ca(OH)2等,盐有NaCl、Na2SO4、Na2CO3、NaNO3、Na2SO3等;
答案为:H2SO4(或HNO3或H2CO3等均可);NaOH(或KOH);Na2SO4(或K2CO3或Na2SO3或NaNO3等)
(3)双氧水在二氧化锰的催化作用下制取氧气,反应的化学方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
答案为:2H2O2![]() 2H2O+O2↑
2H2O+O2↑

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2 (g)![]() CH3OH(g) △H1;
CH3OH(g) △H1;
②CO2 (g)+3H2 (g)![]() CH3OH(g)+H2O(g) △H=-58kJ/mol;
CH3OH(g)+H2O(g) △H=-58kJ/mol;
③CO2 (g)+H2(g)![]() CO(g)+H2O(g) △H==+41k J/ mol。
CO(g)+H2O(g) △H==+41k J/ mol。
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下表:
化学键 | H—H | C-O | C≡O | H-O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=___________。
(2)合成气组成n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图甲所示。α(CO)值随温度升高而___________(填“增大”或“减小”),其原因是_____;图中的压强由大到小为___________,其判断理由是_____________。

(3)若将1mol CO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为K1___________KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是___________(填序号)。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=0断裂的同时有6个H-H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为____,该温度下的平衡常数为___________;若容器容积不变,下列措施可增加甲醇产率的是___________。(填序号)。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2