题目内容
17.一定条件下,发生反应:①M(s)+N(g)?R(g)△H=-Q1kJ•mol-1,②2R (g)+N(g)?2T (g)△H=-Q2kJ•mol-1. Q1、Q2、Q3均为正值.下列说法正确的是( )
| A. | 1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | |
| B. | 将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | |
| C. | 当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+$\frac{{Q}_{2}}{2}$kJ | |
| D. | M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3<Q1 |
分析 A、反应焓变为负值,反应是放热反应,反应物能量高于生成物;
B、反应是可逆反应不能进行彻底;
C、依据热化学方程式和盖斯定律计算分析判断;
D、固体变化为气体吸收能量,反应是放热反应焓变为负值.
解答 解:A、反应焓变为负值,反应是放热反应,反应物能量高于生成物,1mol R(g)的能量总和小于1mol M(s)与1mol N(g)的能量总和,故A错误;
B、反应是可逆反应不能进行彻底,将2mol R(g)与1mol N(g)在该条件下充分反应,放出热量<Q2 kJ,故B错误;
C、依据热化学方程式和盖斯定律计算分析判断,①+$\frac{②}{2}$得到,M(s)+$\frac{3}{2}$N(g)?T(g)△H=-(Q1+$\frac{{Q}_{2}}{2}$)kJ/mol,则C正确;
D、固体变化为气体吸收能量,反应是放热反应焓变为负值,M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3>Q1,故D错误;
故选C.
点评 本题考查了化学反应能量变化,盖斯定律计算应用,注意焓变为负值是放热反应,题目难度中等.

练习册系列答案
相关题目
7.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A. | 全氟丙烷不能使溴水褪色 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 分子中三个碳原子可能处于同一直线上 |
8.设NA 为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 1 L 0.1 mol•L-1盐酸含有0.1NA个HCl分子 | |
| D. | 1mol Cl2与足量的铁反应,转移的电子总数为2NA个 |
9.下列实验现象能说明SO2具有漂白性质的是( )
| A. | 将SO2通入溴水,溴水褪色 | |
| B. | 将SO2气体通入滴入有酚酞的NaOH溶液中,红色褪色 | |
| C. | 将SO2通入品红溶液中,品红溶液褪色 | |
| D. | 将SO2通入酸性高锰酸钾溶液中,溶液褪色 |
6.下列分子式表示的物质一定是纯净物的是( )
| A. | C2H60 | B. | C7H8O | C. | CH4O | D. | C2H4Cl2 |
4.下列能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成S.
①HCl比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成S.
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①②③ |
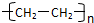

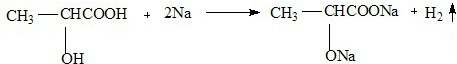 .
.