题目内容
Na2SO3是常用的抗氧剂。
(1)实验室通常用浓硫酸(1:1)和Na2SO3微热制备SO2气体,
反应方程式为: ,制备的SO2气体中通常含有水蒸气,下列干燥剂能干燥SO2气体的是: ;
A.浓硫酸 B.碱石灰 C.无水CaCl2
(2) 少量SO2气体通入NaOH溶液中可得NaOH和Na2SO3的混合溶液,向该混合溶液中加入少许溴水,振荡后溶液变为无色。碱性溶液中Br2与Na2SO3发生氧化还原反应,反应的离子方程式为______________;
(3)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告;
限选试剂:2 mol·L-1HCl;1 mol·L-1H2SO4;1mol·L-1HNO3;1 mol·L-1BaCl2;
1 mol·L-1Ba(NO3)2;0.1 mol·L-1AgNO3;CCl4;苯;新制饱和溴水;新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管A中,滴加2 mol·L-1HCl至溶液呈酸性,加入几滴________(填试剂),振荡 | ________,证明待测液中含SO32- |
| 步骤② | 另取少量待测液于试管B中,加入 ,再滴加适量 1 mol·L-1 BaCl2溶液 | |
| 步骤③ | 另取少量待测液于试管C中, ,振荡,静置后观察颜色 | 溶液分层,上层液体呈橙红色,证明待测液中很Br- |
(1)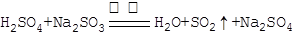 2 分 AC 2分 每个选项1分,错选不给分
2 分 AC 2分 每个选项1分,错选不给分
(2)SO32-+Br2+2OH-=H2O+SO42-+2Br- 2分
(3)
(每空2分)编号 实验操作 预期现象和结论 步骤① 新制饱和溴水 溴水褪色 步骤② 加入过量的2 mol·L-1盐酸, 有白色沉淀生成,证明待测液中含SO42- 步骤③ 加入足量新制饱和氯水,再加入苯
解析试题分析:(1)根据强酸制弱酸,浓硫酸(1:1)和Na2SO3微热可制取SO2,化学方程式为: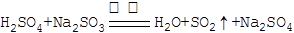 ;SO2为酸性氧化物,不能用碱石灰干燥,可用浓硫酸或无水CaCl2干燥,故A、C项正确。
;SO2为酸性氧化物,不能用碱石灰干燥,可用浓硫酸或无水CaCl2干燥,故A、C项正确。
(2)Br2把Na2SO3氧化为SO42?,在碱性条件下离子方程式为:SO32-+Br2+2OH-=H2O+SO42-+2Br-。
(3)SO32?利用还原性检验,加入新制溴水,SO32?被Br2氧化,现象为溴水褪色;SO42?的检验应先加入足量稀盐酸,排除Ag+、CO32?、SO32?等离子的干扰,然后加入BaCl2溶液,有白色沉淀生成,证明待测液含有SO42?;加入足量新制饱和氯水,可把Br?氧化为Br2,因为上层液体呈橙红色,所以加入了密度小于水的苯。
考点:本题考查方程式的书写、干燥剂的选择、离子的检验。

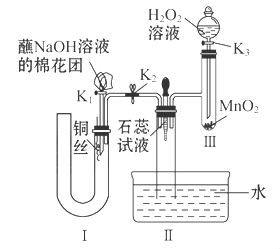
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、硬质玻璃管常作为气体和固体反应的场所,如图(其他装置省略,必要时可加热)。
下列实验描述不正确的是
| A.固体A为无水硫酸铜时,可以检验气体X中是否含有水蒸气 |
| B.固体A为铜时,可以除去N2中的O2 |
| C.在空气流作用下,加热氯化铁晶体得到纯净的无水氯化铁 |
| D.将氨气和空气混合气通过灼热的铂丝,可看到有红棕色气体生成 |
a、b、c三个棉球变化如下表。请填写表中的空白:
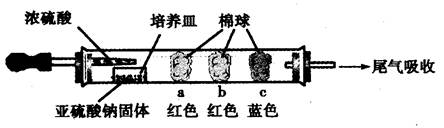
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 结论:该气体具有 性 |
 Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)